ALK、ROS1、NTRK、NRG1といったまれな遺伝子変異陽性肺がんへの画期的な検査法
BFAST試験:血液検体を用いたNGS解析の有用性を評価
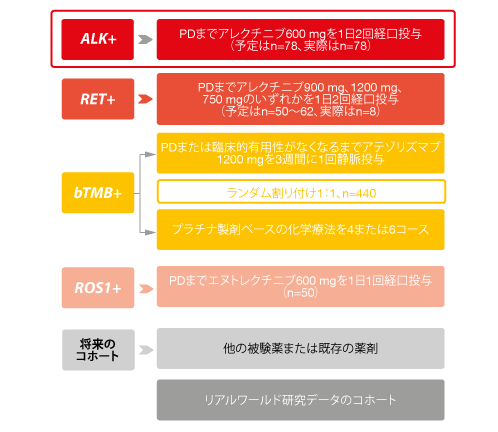
分子標的治療には遺伝子検査が不可欠だが、組織の採取や組織診が臨床現場での足かせになっていることが知られている。だが、血液検体を用いた次世代シーケンス(NGS)解析で一部の難問を克服できるようになるかもしれない。進行NSCLC患者を対象に、血液バイオマーカーとファーストライン治療に用いる分子標的治療薬もしくは免疫チェックポイント阻害薬の臨床活性との相関性を前向きに評価するため、第Ⅱ相・第Ⅲ相国際共同マルチコホートBFAST試験を行った。 血液検体を用いたNGS解析の臨床有用性を立証するため、同解析の結果だけを基に患者を各治療群に割り付けた。血液検体から検出したバイオマーカーはALK、RET、ROS1となり、遺伝子変異量も測定した(図)。同試験は、問題になる遺伝子変異の検出と対象のNSCLC患者に適した分子標的治療薬や免疫チェックポイント阻害薬の特定に、血液検体を用いるNGSのみを利用した初めての臨床試験である。
本総会ではGadgeelらが、ALK遺伝子変異陽性コホートに関する成績を発表した[1]。ALK阻害薬のアレクチニブの臨床活性が、組織診の結果を基準に患者を選定した国際共同ALEX試験の成績と一致することを示すため、このコホートを選んだ[2]。ベースライン時にNGS解析を受けた全患者(n=2,219)の5.4%からALK遺伝子の転座を検出し、予測値の5%と一致した[3]。ALEX試験でアレクチニブ群に割り付けられた患者の特性と、ベースライン時のそれがほぼ同じだった87人をコホートに組み入れて、アレクチニブ600 mgを1日に2回投与した。
治験責任医師が確認したORRを主要評価項目とした。治験責任医師が確認したORRは87.4%、独立評価機関(IRF)が確認したそれは92.0%に達し、ALEX試験で確認した72.4%を上回る結果となった[4]。11人(12.6%)に完全奏効したとIRFが判定した。ベースライン時に認めたCNS転移は奏効率に影響を与えていなかった。奏効を確認した患者の6か月時点の無再発生存率は90.4%だった。解析時にはまだPFSの中央値の時期に達していなかったが、12か月時点のそれは78.38%になっていた。アレクチニブの安全性プロファイルは、第Ⅲ相試験や市販後調査で得た内容と一致していた。ALK遺伝子変異陽性NSCLC患者の治療法を判断する上で、血液検体を用いるNGS解析には臨床的有用性があると上述の結果から受け取れた。
図:BFAST試験で対象になった患者(bTMB:血液中の遺伝子変異量)
ALEX試験でのPFSに関する最終成績
治療経験のないALK遺伝子変異陽性進行NSCLC患者303人を対象に、アレクチニブとクリゾチニブの有効性および安全性を比較検討するべく、国際共同第Ⅲ相ランダム化比較ALEX試験を行った。中央値にして37.8か月間追跡調査したアレクチニブ群、同じく23.0か月間追跡調査したクリゾチニブ群の、すべて出そろったPFSのデータそしてOSの最新データをMokらが報告した[4]。
データ解析結果によると、治験責任医師が評価したPFSの中央値はアレクチニブ群が34.8か月、クリゾチニブ群が10.9か月になっていた(HR:0.43、
p<0.0001)。ベースライン時のCNS転移の有無でPFSの延長効果に違いがみられることはなかった(HRはCNS転移がある群が0.37、ない群が0.46)。アレクチニブ群の場合、ベースライン時のCNS転移の有無にかかわらず、PFSに関連する無イベント生存率も高くなっていた。4年時点の無イベント生存率は、アレクチニブ群全体で43.7%に達していたが、クリゾチニブ群にここまでの数値に達した患者はいなかった。
全生存率全般のデータはすべて出ていなかったが、4年時点のOSはアレクチニブ群が64.5%、クリゾチニブ群が52.2%だった。確認したアレクチニブ群のORR72.4%とクリゾチニブ群の60.9%は、データカットオフ時点の主要評価項目のそれと同じだった[2]。 治療期間の中央値に開きがあったことは(前者は27.7か月、後者は10.8か月)つまり、アレクチニブの安全性プロファイルの方が良好な内容だったことを表している。治療経験のないALK遺伝子変異陽性進行NSCLC患者に対してアレクチニブは優れた有効性を示すことを最終解析で確認できたと、著者らは締めくくった。
NTRK融合遺伝子陽性がんへのエヌトレクチニブの有効性
神経栄養因子受容体チロシンキナーゼ(NTRK)融合遺伝子はドライバー遺伝子であり、固形がんの中でも肺がん症例のおよそ0.3%に認められている[5]。
TRKA/B/C、ROS1、ALK阻害薬のエヌトレクチニブは、NTRK融合遺伝子陽性がん患者の全身だけでなくCNSにも作用するように設計されている。米食品医薬品局は、15か国の150以上の医療機関で行われたALKA-372-001試験、
STARTRK-1試験、STARTRK-2試験の第I相・第Ⅱ相試験での成績の統合解析結果に基づいて、NTRK融合遺伝子陽性固形がんに罹患した成人患者への使用を適応に、迅速承認制度を利用してアレクチニブを承認した[6]。いずれの臨床試験にもNTRK、ROS1、ALKのいずれかの遺伝子変異が陽性の固形がん患者が組み入れられている。
さらに5か月間追跡調査をし、統合解析した最新結果をRolfoらが報告した
[7]。NTRK融合遺伝子陽性固形がん患者54人が有効性の評価対象になり、このうち10人が肺がんに罹患していた。統合解析を行った時点でORRは59.3%の高さを維持しており、4人(7.4%)が完全奏効の判定を受けていた。奏効期間の中央値は12.9か月になり、PFSの中央値は11.8か月、OSの中央値は23.9か月となっていた。ベースライン時のCNS転移の有無によって、全身の奏効率に差異が生じることはなかった。著者らは、OSも奏効期間も、以前の解析結果よりも長くなっていると述べた[6]。
ベースライン時に脳転移のあった患者には、エヌトレクチニブの臨床的意義のある、安定した効果がみられた。頭蓋内ORRは54.5%、PFSは14.3か月になったが、頭蓋内ORRの中央値はこの時点でまだ判明していなかった。
ROS1融合遺伝子陽性患者への有効性
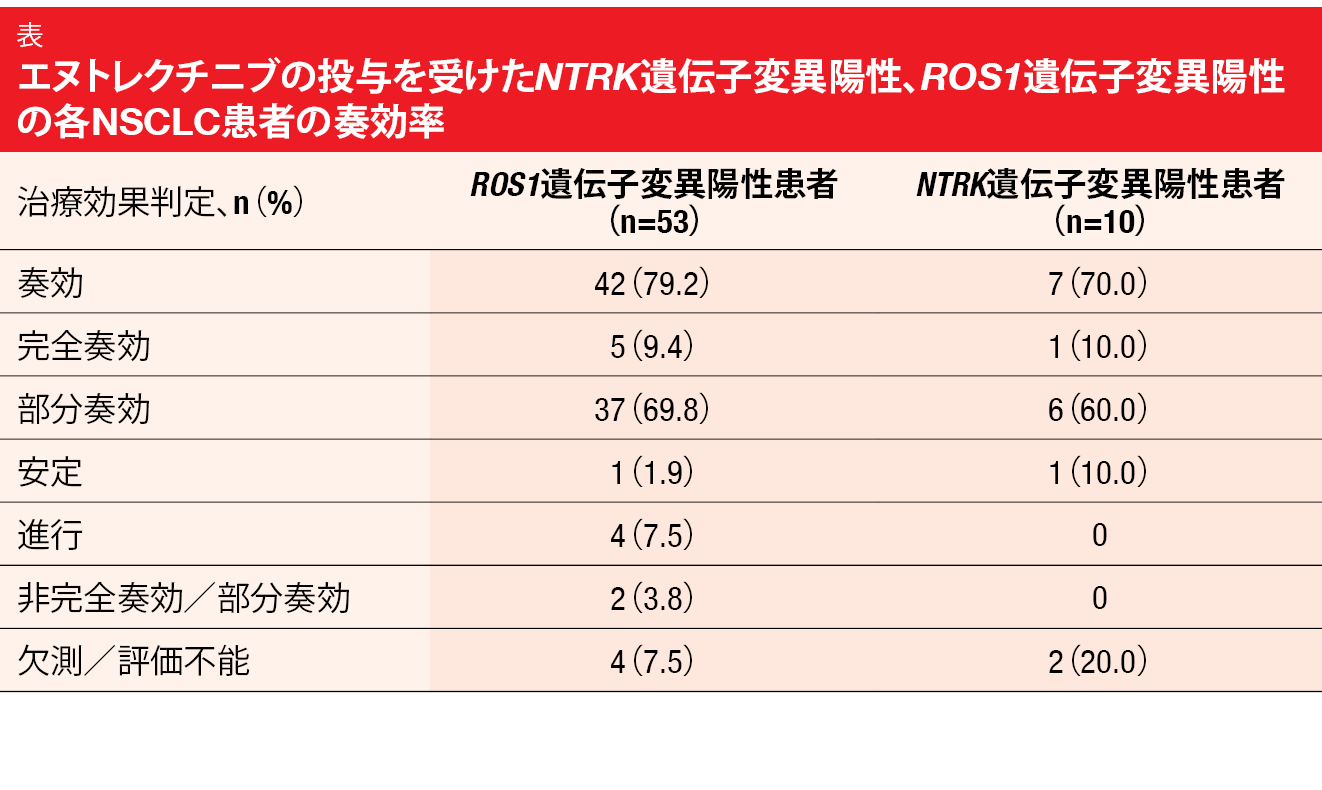
ALKA-372-001、STARTRK-1、STARTRK-2の各試験に参加した肺がん患者に関する最新の統合解析を、De Braudらが報告した[8]。肺がん患者63人のうち53人がROS1遺伝子変異陽性、10人がNTRK遺伝子変異陽性だった。ORRはROS1遺伝子変異陽性群が79.2%、NTRK遺伝子変異陽性群が70.0%となり(表)、どちらの遺伝子変異群でも患者の10%ずつが完全奏効の判定を受けた。前者の奏効期間の中央値は24.6か月、PFSの中央値は19.0か月だったが、この時点ではまだOSの中央値は判明していなかった。
この群では脳転移のある患者(ORRは73.9%、奏効期間の中央値は評価不能)にも脳転移のない患者(ORRは83.3%、奏効期間の中央値は24.6か月)と同様に、臨床的に意義があり、安定した効果がみられた。ベースライン時に脳転移を認めた患者の頭蓋内奏効率は55%だった。この奏効期間の中央値は12.9か月、頭蓋内PFSの中央値は7.7か月に上った。3試験の統合解析結果からはエヌトレクチニブの忍容性の高さが示され、安全性プロファイルも以前の報告と一致していた。
表 エヌトレクチニブの投与を受けたNTRK遺伝子変異陽性、ROS1遺伝子変異陽性の各NSCLC患者の奏効率
NRG1融合遺伝子変異陽性がんへのアファチニブの使用経験
複数の固形がんで、問題になるNRG1融合遺伝子を検出している。この遺伝子がErbBシグナル伝達を介して細胞を増殖させており、ドライバー遺伝子として機能しているのかもしれない[9~11]。
全固形がんの約0.2%にこの遺伝子変異が生じているとの推測があるが、粘液産生性肺腺がんではこれが最大で31%になるという報告がある[11、12]。NRG1融合遺伝子変異陽性がんにはErbBシグナル伝達が関与しているため、ErbB受容体ファミリー阻害薬のアファチニブはこの遺伝子変異が陽性の患者への治療の選択肢になりうる。Liuらは、この仮説を裏付ける肺がん患者4人を含めた7人に関する知見を報告した[13]。この4人のうち3人は粘液産生性肺腺がん以外のがんの治療を、1人が粘液産生性肺腺がんの治療を受けていた。4人全員がアファチニブを投与されるまでに複数の治療ラインを重ねていて、このうちの1人は治療ラインの数が14にも上った。
3人が最良総合効果の部分奏効の判定を受けて効果が安定していることを証明し(最良総合効果の持続期間は18~24か月)、このうち2人の治療が続いている。1人は安定の判定を受け、その状態が4か月間続いた。NRG1融合遺伝子変異陽性がんでも、他にドライバー変異が特に認められない患者にはアファチニブが治療の選択肢になりうることが、以上の知見でさらに裏付けられたと著者らは総括した。NRG1融合遺伝子の発現率が比較的高い粘液産生性肺腺がん患者には、遺伝子検査の実施が特に重要になるだろう。
参考文献:
- Gadgeel SM et al., Phase II/III blood-first assay screening trial (BFAST) in treatment-naïve NSCLC: initial results from the ALK+ cohort.ESMO 2019, abstract LBA81_PR
- Peters S et al., Alectinib versus crizotinib in untreated ALK-positive non-small-cell lung cancer.N Engl J Med 2017; 377(9): 829-838
- Dearden S et al., Mutation incidence and coincidence in non small-cell lung cancer: meta-analyses by ethnicity and histology (mutMap).Ann Oncol 2013; 24(9): 2371-2376
- Mok T et al., Final PFS, updated OS and safety data from the randomized, phase III ALEX study of alectinib versus crizotinib in untreated advanced ALK+ NSCLC.ESMO 2019, abstract 1484PD
- Okamura R et al., Analysis of NTRK alterations in pan-cancer adult and pediatric malignancies: implications for NTRK-targeted therapeutics.JCO Precis Oncol 2018; 2018. doi: 10.1200/PO.18.00183.Epub 2018 Nov 15.
- https://www.roche.com/media/releases/med-cor-2019-08-16.htm
- Rolfo C et al., Updated efficacy and safety of entrectinib in patients with NTRK fusion-positive tumours: integrated analysis of STARTRK-2, STARTRK-1 and ALKA-372-001.ESMO 2019, abstract 476P
- De Braud F et al., Entrectinib in locally advanced/metastatic ROS1 and NTRK fusion-positive non-small cell lung cancer: updated integrated analysis of STARTRK-2, STARTRK- and ALK-372-00.ESMO 2019, abstract 1488PD
- Fernandez-Cuesta L & Thomas RK, Molecular pathways: targeting NRG1 fusions in lung cancer.Clin Cancer Res 2014; 21(9): 1989-1994
- Duruisseaux M et al., NRG1 fusion-positive lung cancers: clinicopathologic profile and treatment outcomes from a global multicenter registry.J Clin Oncol 37, 2019 (suppl; abstr 9081)
- Jonna S et al., Detection of NRG1 gene fusions in solid tumors.Clin Cancer Res 2019; 25(16): 4966-4972
- Trombetta D et al., Frequent NRG1 fusions in Caucasian pulmonary mucinous adenocarcinoma predicted by Phospho-ErbB3 expression.Oncotarget 2018; 9(11): 9661-9671
- Liu SV et al., Targeting NRG1 fusions in multiple tumour types: afatinib as a novel potential treatment option.ESMO 2019, abstract 1969P
More posts
まれなドライバー変異であっても重要性は高い
まれなドライバー変異であっても重要性は高い Stephen Liu, MD, Lombardi Comprehensive Cancer Center at Georget
CNS病変の存在は治療成功の妨げにならない
CNS病変の存在は治療成功の妨げにならない 診断時にあった神経症状の負担が生存率に及ぼす影響 転移性NSCLC患者の約35%に脳転移を認めており、これがさまざまな神経症状の
ALK、ROS1、NTRK、NRG1といったまれな遺伝子変異陽性肺がんへの画期的な検査法
ALK、ROS1、NTRK、NRG1といったまれな遺伝子変異陽性肺がんへの画期的な検査法 BFAST試験:血液検体を用いたNGS解析の有用性を評価 分子標的治療には遺伝子検
血管新生阻害薬と免疫チェックポイント阻害薬とのシナジー効果に関する調
血管新生阻害薬と免疫チェックポイント阻害薬とのシナジー効果に関する調 主立ったドライバー変異のない進行非扁平上皮NSCLCにとっては、免疫チェックポイント阻害薬が登場したこ
EGFR TKIと血管新生阻害薬を併用するフロントライン治療
EGFR TKIと血管新生阻害薬を併用するフロントライン治療 EGFR遺伝子変異陽性肺がんの治療を受けていない患者には、第一世代のEGFR TKIに抗VEGF抗体のベバシズ
EGFR遺伝子変異陽性肺がん:あらゆる治療ラインにわたる至適治療にかかわる問題点
EGFR遺伝子変異陽性肺がん:あらゆる治療ラインにわたる至適治療にかかわる問題点 FLAURA試験:オシメルチニブを用いたファーストライン治療後のOS EGFR遺伝子変異陽