EGFR遺伝子変異陽性肺がん:あらゆる治療ラインにわたる至適治療にかかわる問題点
FLAURA試験:オシメルチニブを用いたファーストライン治療後のOS
EGFR遺伝子変異陽性進行NSCLC患者へのフロントライン治療には、EGFRチロシンキナーゼ阻害薬(TKI)を用いるのが一般的である。三世代のTKIが使用できるのでさまざまな選択肢があるが、どの順番で使用すればいいのか現段階では明らかになっていない。そこで、第Ⅲ相二重盲検ランダム化比較FLAURA試験で、第三世代のEGFR TKIのオシメルチニブを、第一世代のEGFR TKIのゲフィチニブとエルロチニブとフロントライン治療に用いて比較した。一次解析の時点ではオシメルチニブ群に統計学的に有意なPFSの改善がみられたが
(オシメルチニブ群は18.9か月、第一世代群は10.2か月、HR:0.46、p<0.001)、これ以外の生存に関する項目の結果はまだ出そろっていなかった[1]。副次評価項目の中心としたOSに関する最終解析結果を、Ramalingamらが本総会で発表した[2]。
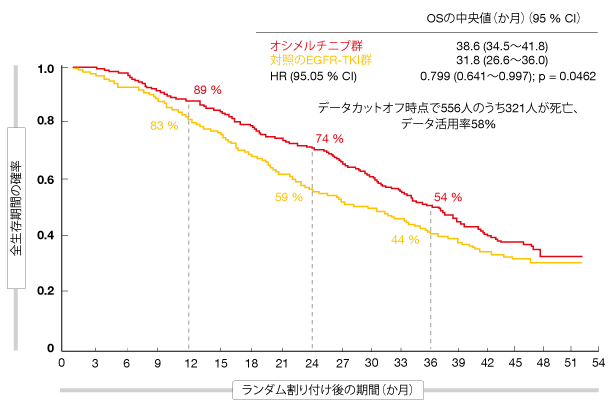
同試験では第一世代群に比べて、オシメルチニブ群に統計学的有意かつ臨床的意義のあるOSの延長が認められた(オシメルチニブ群は38.6か月、第一世代群は31.8か月、HR:0.799、p=0.0462、
図1)。24か月時点で生存していた患者は前者が74%、後者が59%となり、36か月時点ではこれが54%と44%になった。OSを副次評価項目にしたため、サブグループごとにOSの延長効果を評価できるほどの検出力はなかった。しかし、OSの延長効果はアジア人コホートよりもそれ以外の人種のコホートで大きくなったものの、患者全体で見るとオシメルチニブ群の方にOSの延長がみられた。アジア人コホートについては、試験開始からの3年間の延長効果がカプランマイヤー生存曲線に現れていた。36か月目からは打ち切りが増え、死亡・転移の発生数が減ったため、データの解釈が困難になった。
図1:FLAURA試験でのオシメルチニブ群とゲフィチニブ(またはエルロチニブ)群の最終的な全生存率
セカンドライン以降の治療
次のラインの治療を始めるまでの期間または死亡までの期間は、オシメルチニブ群が第一世代群のほぼ2倍になった
(前者は25.5か月、後者は13.7か月、
HR:0.478、p<0.0001)。36か月時点でこれまでの治療を続けていたのは前者が28%、後者が9%だった。両群の13%が次の治療に進むことはできず、その大半は病勢の進行後に死亡した。オシメルチニブ群で、病勢の進行後にセカンドライン治療として抗がん剤の投与を始めたのは47%に上り、細胞毒性化学療法がその大半を占めた(68%)。第一世代群でセカンドライン治療に進んだ患者は65%になり、その大半に投与したのはオシメルチニブで(47%)、化学療法を始めたのは22%だった。
同試験ではオシメルチニブ群の投与期間が第一世代群のそれよりも長くなったが(前者は20.7か月、後者は11.5か月)、オシメルチニブの毒性プロファイルは良好な内容で、既知の毒性プロファイルとも一致していた。治療関連と考えられるグレード3以上の有害事象が生じた割合は、オシメルチニブ群では比較的小さかった(前者は18%、後者は29%)。
同試験のOSに関する最終結果が出れば、EGFR遺伝子変異陽性進行NSCLC患者へのフロントライン治療にはオシメルチニブを標準治療とすることを促すだろうと著者らは述べた。オシメルチニブは他のEGFR TKIに比べて、初めて単独療法でOSを統計学的有意な延命効果を示した薬剤である。
血中循環腫瘍DNAのモニタリングによる病勢進行の早期発見
病勢進行および獲得耐性のメカニズムを早期に分子レベルで発見できるようにするため、FLAURA試験で探索解析を行って血中循環腫瘍DNA(ctDNA)を連続して調査した[3]。同試験でランダムに割り付けた患者556人のうち122人がctDNA解析の対象になった(オシメルチニブ群は42人、第一世代群は80人)。薬剤耐性変異で調べた遺伝子はC797SとT790Mのみである。
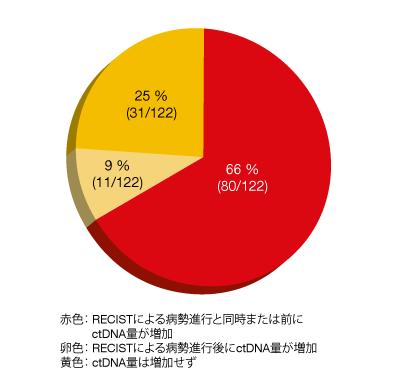
RECISTガイドラインが定めた病勢進行よりも先にctDNA量が増加した、または同時に起きた患者は、両群で66%に上った(図2)。ctDNA量が増加するまでの期間の中央値はどちらの群もほぼ同じだった(オシメルチニブ群は3.0か月、第一世代群は2.6か月)。122人のうちの47%に、ctDNA量の増加と同時に耐性変異が認められた。ctDNA解析を行ったところ、オシメルチニブを中央値にして16.7か月投与した後、8%の患者からC797S遺伝子変異を検出したのに対し、第一世代のEGFR TKIを中央値にして8.4か月投与した後、74%の患者からT790M遺伝子変異を検出した。薬剤耐性変異の検出からRECISTガイドラインに基づいた病勢進行までの期間の中央値は、全体で1.4か月である。今回のctDNA解析からは、ctDNAを長期にわたって測定することで、実際に病勢が進行するよりも先にその徴候を捉えたり、薬剤耐性変異を検出したりできる可能性が判明した。この解析以外にも、次世代シーケンサーを利用した解析も行われている。
図2:オシメルチニブによるファーストライン治療群における、RECISTガイドラインに基づいた病勢進行を認めた時期とctDNA量が増加した時期
オシメルチニブへの耐性獲得に関する知見
オシメルチニブへの耐性獲得のメカニズムについては、31人の患者を組み入れた前向きMATCH-R試験で行った解析で判明している[4]。同試験では、オシメルチニブの治療を受ける患者から腫瘍組織を採取し、クローン構造の進展の仕方を評価した。治療中に病勢の進行が認められた時点で組織生検および血漿を利用するリキッドバイオプシーを行い、任意で病勢が進行する前にも行った。がん細胞の遺伝子変異をすべて確認し、耐性獲得が確実/その可能性ありまたは遺伝子変異の同時発生に分類した。
このようにして調べたところ、耐性獲得のメカニズムは不均一で予想以上に複雑であることが分かった。2種類以上の遺伝子変異を45%の患者から検出し、薬剤耐性変異1種類を19%、同2種類を29%、同3種類を16%から検出した。TP53遺伝子の変異が同時に起きていることが最も多かった(71%)。遺伝子変異の同時発生と薬剤耐性変異の数との間には、統計学的に有意な相関性があった(p=0.002)。目標にしていた薬剤耐性変異(EGFR遺伝子変異、RETとMETの遺伝子再構成など)を39%の患者から検出したのに対して、それ以外の薬剤耐性変異(NTRK1遺伝子再構成、KIF5B-RET融合遺伝子、MET遺伝子増幅、KRAS/NRAS遺伝子変異など)を26%の患者から検出した。なお、35%の患者の薬剤耐性変異の種類はいまだ不明である。
T790M変異の喪失は種類が分からない薬剤耐性変異と同時に生じることがより多くなっており、T790M変異を維持している患者に比べて病勢がより速く進行することで治療開始から中止までの期間が短くなることと関連していた(変異喪失群は13か月、変異維持群は22か月、HR:2.16、p=0.046)。今回の調査ではかなりの数の融合遺伝子を確認しており(16%)、その一部が標的分子になる可能性がある。臨床転帰を改善するには併用療法が必要になるだろうと、著者らは語った。
GioTag試験:アファチニブ療法後のオシメルチニブ療法
EGFR TKIによる治療中に病勢が進行することは避けられないため、次の治療をどうするかという問題が生じる。いくつもの意見が、アファチニブからオシメルチニブに切り替えることの根拠になっている。EGFR T790Mゲートキーパー変異は、第一世代と第二世代のEGFR TKIへの耐性を獲得するメカニズムの中心的存在となっている。第二世代のEGFR TKIであるアファチニブへの耐性獲得で、T790Mゲートキーパー変異が生じているのは50~70%と推測したが[5~8]、エクソン19欠失変異を検出している患者ではゲートキーパー変異の率が75%にもなった[9]。そのため、アファチニブによる治療中に病勢が進行した患者の大部分がセカンドライン治療のオシメルチニブ投与の対象になり、AURA3試験でT790M変異陽性肺がんに顕著は臨床活性を示す結果となった[10]。一方で、オシメルチニブ療法を受ける間に病勢が進行した後、耐性獲得の兆しになるようなものは見つからなかった
[11、12]。薬剤耐性変異が生じると分子標的治療薬の選択肢がなくなるため、ほとんどの場合、化学療法を行うことになる。
こういった知見を受けて、アファチニブによるファーストライン治療の最中にT790M変異が生じたためオシメルチニブに切り替えた患者の臨床転帰を、国際共同観察GioTag試験で評価することになった。同試験にはヨーロッパ、アジア、北米の10か国の医療機関が参加している。同試験に参加した患者の大部分は、ECOGパフォーマンスステータス(PS)が低いもしくは脳転移があるという理由で、治験には参加できずにいた。参加者の15%はECOG PSが2以上、10%は脳転移が安定した状態だった。
Hochmairらが本総会で発表した最新の中間解析結果によると、全患者203人のOSの中央値は41.3か月となっており(表1)[13]、24か月時点で生存していたのは80%に上った。エクソン19欠失変異陽性群では、OSの中央値は45.7か月、2年生存率は82%になった。治療成功期間(TTF)の中央値は全患者で28.1か月、エクソン19欠失変異陽性群で30.6か月となった。
オシメルチニブ単独療法群のTTFは15.6か月で、アファチニブによるファーストライン治療後のセカンドライン治療にオシメルチニブを用いると、著しい臨床的有用性を期待できることが見てとれた。FLAURA試験でファーストライン治療にオシメルチニブを投与した期間の中央値は16.2か月だった[1]。EGFR遺伝子変異陽性NSCLC患者には、アファチニブからオシメルチニブに切り替える治療法が行えるだろうと、著者らは結論づけた。ただ、前述以外のEGFR TKIを順番に使う治療を行った患者のOSを評価するためには、前向き試験のデータが必要になる。
EGFR TKIを切り替える療法に関するドイツとフランスのデータ
EGFR TKIを切り替える妥当性を、リアルワールド研究の結果がさらに裏付けることとなった。リアルワールド研究である前向き非介入GIDEON試験がドイツの49施設で行われた。同試験で対象になったのはアファチニブのフロントライン治療を受ける、EGFR遺伝子変異陽性進行NSCLC患者151人である。アファチニブの使用後、治療ラインを問わずオシメルチニブを使用した患者29人に関するデータから、この治療レジメンには良好な転帰をもたらす可能性があると読み取れた[14]。アファチニブの投与開始から2年後に生存していた患者は89.3%だったが、解析時ではOSの中央値を割り出すデータがそろっていなかった。既発表データによると[15]、同試験でセカンドライン以降にオシメルチニブを投与された患者の人数は、EGFR遺伝子変異陽性患者の中でも、とりわけエクソン19欠失変異陽性群で多くなっていた。
French nationwide claims(フランス国内のレセプト情報)と入院患者に関するデータベースを基に行った同様の試験でも、T790M変異が生じた患者にはEGFR TKIの切り替えが有効なことが判明した[16]。そこで、Girardらが実臨床で第一世代や第二世代のEGFR TKIからオシメルチニブに切り替えた患者の治療期間、OS、医療制度にかかる負担を評価した。ここで対象になったのはEGFR変異陽性進行NSCLC患者576人である。治療期間(第一世代や第二世代のEGFR TKIの処方開始日からオシメルチニブ療法の中止または死亡までの期間)の中央値は34か月だった。24か月時点でEGFR TKIの投与が続いていたのは64.8%、36か月時点では48.2%となった。第一世代のEGFR TKIの投与期間の中央値は13.6か月、その後のオシメルチニブの投与期間の中央値は11.9か月である。EGFR TKIを切り替える治療を受けた患者の全生存期間は37.1か月で、36か月時点で患者の51.6%が生存していた。対象患者全体では、患者1人当たりの年間平均医療費は62,806ユーロに上り、そのうちの77%をEGFR TKIの薬代が占めていた。
実臨床でのアファチニブによるファーストライン治療
実臨床で得たエビデンスは、第一選択薬としてのアファチニブの有効性を強調している。第Ⅲ相国際共同前向き単群1200.55試験では、EGFR遺伝子変異陽性NSCLC患者を対象に、第一選択薬としてのアファチニブの有効性および安全性を評価している[17]。データ解析時に治療を受けていた患者は合計で479人になった。この患者の大部分はECOG PS 1で(57%)、17%に脳転移が認められた。つまり、同試験には治験に参加できない患者も一定の割合で組み入れたことになる。
有効性と安全性に関する中間解析結果も、LUX-Lung 3、6、7ピボタル試験で得た結果と一致していた[18~20]。症状増悪までの期間(TTSP)の中央値は14.9か月、PFSの中央値は13.4か月だった。ECOG PS 2群、無症候性脳転移群、まれはEGFR遺伝子変異陽性群、複数の治療ライン経験群と、幅広いサブグループに臨床的有用性が認められた。長期的な有効性がみられたのはエクソン19欠失変異群(TTSPは19.3か月、PFSは15.9か月)およびECOG PSが0群と1群(TTSPは15.8か月、PFSは13.8か月)だった。患者の46%に治療が奏効し、病勢コントロール率は86%になった。有害事象の上位を占めたのは下痢と発疹で、どちらも投与量を減量することで軽減し、投与中止に至った患者はわずかだった(下痢は3%、発疹は1%)。
1200.55試験のデータと、実臨床でEGFR-TKIによる治療が未経験の患者を対象にアファチニブを評価した、大規模前向き第Ⅲb相試験のデータをプール解析用に収集した[21]。全体で1020人が解析対象になり、そのうち68.8%がECOG PS 1だった。ベースライン時に脳転移を認めた患者と、まれなEGFR遺伝子変異を検出した患者は、それぞれ18%だった。31%の患者がこれまでに少なくとも治療ラインを1つは受けていた。
この解析結果からは有効性に期待が持て、安全性については予測も治療も可能であることが分かり、各LUX-Lung試験のデータとも一致していた[18~20]。患者全体のTTSPの中央値は14.6か月、PFSの中央値は12.9か月になり、奏効率は52.7%に、奏効期間は12.9か月になった。病勢コントロール率はほぼ90%に達し、この状態が13.9か月持続した。投与量を1日40 mgから30 mgに減量した患者は40.5%になり、さらに20 mgまで減量した患者は12.1%になった。
EGFR TKI切り替えの障害
日常の臨床現場ではEGFR TKIを簡単に切り替えられないことから、第一世代や第二世代のEGFR TKIの治療を受け、
EGFR遺伝子変異陽性NSCLCへのオシメルチニブの適応の承認後から最後の診察までを受けた患者の臨床経過を後ろ向きに解析し、評価することがドイツで行われた[22]。このような解析を行った目的は、実臨床での患者の特徴と切り替えの限界をより深く理解するためである。
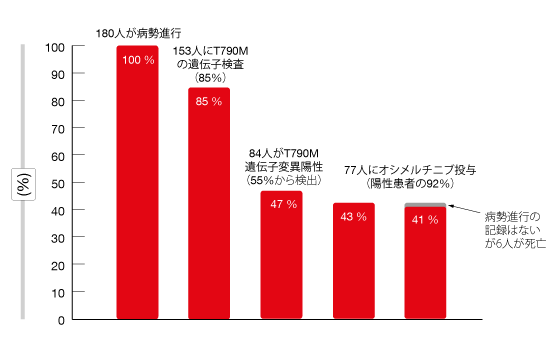
ファーストライン治療で最も多く用いたEGFR TKIはアファチニブ(49%)、次いでエルロチニブ(36%)、ゲフィチニブ(15%)の順である。第一世代や第二世代のEGFR TKIによる治療がうまくいかなかった患者186人のうち、153人(85%)のT790M遺伝子変異を検査し、84人(55%)からこの変異を検出した(図3)。
6人の患者が死亡したが病勢が進行したという記録はなく有害事象の発現を主な理由に投与中止あるいは薬剤の切り替えがあった。第一世代や第二世代のEGFR TKIによる治療を受けていた患者の41%が、最終的にオシメルチニブに切り替えることになった。EGFR TKIによるファーストライン治療が失敗した患者の、治療開始日から起算したOSの中央値は35か月になった。ファーストライン治療の後にオシメルチニブに切り替えた患者のOSの中央値は、他の第一世代や第二世代のEGFR TKIに切り替えた患者や、セカンドライン以降の治療を受けなかった患者のそれに比べて、統計学的有意に長くなった(オシメルチニブ群は52か月、その他の群は25か月、p<0.001)。
EGFR TKIの切り替えで問題になるのは、T790M遺伝子変異を測定しないこと、そしてT790M遺伝子変異が陰性の状態で病勢が進行することだと著者らは述べた。およそ25%の患者はEGFR TKIによるファーストライン治療が失敗すると、次の治療を受けなかった。この割合はT790M遺伝子変異を検査した患者(14%)よりも、検査しなかった患者(77%)ではるかに高くなった。T790M遺伝子変異が陽性になった患者の90%以上が、最終的にオシメルチニブに切り替えている。
図3:第一世代や第二世代のEGFR TKIによる治療が失敗した患者186人に行ったT790M遺伝子検査およびオシメルチニブ療法
参考文献:
- Soria JC et al., Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer.N Engl J Med 2018; 378(2): 113-125
- Ramalingam SS et al., Osimertinib vs comparator EGFR-TKI as first-line treatment for EGFRm advanced NSCLC (FLAURA): final overall survival analysis.ESMO 2019, abstract LBA5_PR
- Gray JE et al., Longitudinal circulating tumour DNA (ctDNA) monitoring for early detection of disease progression and resistance in advanced non-small cell lung cancer (NSCLC) in FLAURA.ESMO 2019, abstract LBA85
- Enrico D et al., Multiple synchronous mechanisms may contribute to osimertinib resistance in non-small-cell lung cancer (NSCLC) patients: insights of the MATCH-R study.ESMO 2019, abstract 1526P
- Hochmair MJ et al., Liquid-biopsy-based identification of EGFR T790M mutation-mediated resistance to afatinib treatment in patients with advanced EGFR mutation-positive NSCLC, and subsequent response to osimertinib.Target Oncol 2019; 14(1): 75-83
- Arcila ME et al., Rebiopsy of lung cancer patients with acquired resistance to EGFR inhibitors and enhanced detection of the T790M mutation using a locked nucleic acid-based assay.Clin Cancer Res 2011; 17(5): 1169-1180
- Sequist LV et al., Genotypic and histological evolution of lung cancers acquiring resistance to EGFR inhibitors.Sci Transl Med 2011; 3(75): 75ra26
- Yang JC et al., Osimertinib in pretreated T790M-positive advanced non-small-cell lung cancer: AURA study phase II extension component.J Clin Oncol 2017; 35(12): 1288-1296
- Jenkins S et al., EGFR mutation analysis for prospective patient selection in two phase II registration studies of osimertinib.J Thorac Oncol 2017; 12(8): 1247-1256
- Mok TS et al., Osimertinib or platinum-pemetrexed in EGFR T790M-positive lung cancer.N Engl J Med 2017; 376: 629-640
- Ramalingam SS et al., Mechanisms of acquired resistance to first-line osimertinib: preliminary data from the phase III FLAURA study.Ann Oncol 2018; 29(suppl): LBA50
- Schoenfeld AJ et al., Tissue-based molecular and histological landscape of acquired resistance to osimertinib given initially or at relapse in patients with EGFR-mutant lung cancers.J Clin Oncol 37, 2019 (suppl; abstr 9028)
- Hochmair MJ et al., Afatinib followed by osimertinib in patients with EGFR mutation-positive advanced NSCLC: updated data from the GioTag real-world study.ESMO 2019, abstract 1532P
- Brückl W et al., Sequential treatment with afatinib followed by 3rd generation EGFR-TKI: subgroup analysis of the GIDEON trial – a prospective non-interventional study in EGFR-mutated NSCLC patients in Germany.ESMO 2019, abstract 1527P
- Mok T et al., Osimertinib or platinum-pemetrexed in EGFR T790M-positive lung cancer.N Engl J Med 2017; 376: 629-640
- Girard N et al., TKIseq study: efficacy and burden of TKI sequence of first and second generation followed by osimertinib in non-small-cell lung cancer in the French real-world setting.ESMO 2019, abstract 1528P
- De Marinis F et al., Afatinib in EGFR TKI-naïve patients with EGFR mutation-positive NSCLC: interim analysis of a phase IIIb, multi-national, open-label study.ESMO 2019, abstract 1472P
- Sequist LV et al., Phase III study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations.J Clin Oncol 2013; 31: 3327-3334
- Wu Y-L et al., Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations (LUX-Lung 6): an open-label, randomised phase 3 trial.Lancet Oncol 2014; 15: 213-222
- Park K et al., Afatinib versus gefitinib as first-line treatment of patients with EGFR mutation-positive non-small-cell lung cancer (LUX-Lung 7): a phase 2B, open-label, randomised controlled trial.Lancet Oncol 2016; 17: 577-589
- De Marinis F et al., A combined analysis of two phase IIIb studies of afatinib in EGFR TKI-naïve patients with EGFR mutation-positive NSCLC.ESMO 2019, abstract 1474P
- Christopoulos P et al., Real-world implementation of sequential targeted therapies for EGFR-mutated NSCLC.ESMO 2019, abstract 1538P
More posts
まれなドライバー変異であっても重要性は高い
まれなドライバー変異であっても重要性は高い Stephen Liu, MD, Lombardi Comprehensive Cancer Center at Georget
CNS病変の存在は治療成功の妨げにならない
CNS病変の存在は治療成功の妨げにならない 診断時にあった神経症状の負担が生存率に及ぼす影響 転移性NSCLC患者の約35%に脳転移を認めており、これがさまざまな神経症状の
ALK、ROS1、NTRK、NRG1といったまれな遺伝子変異陽性肺がんへの画期的な検査法
ALK、ROS1、NTRK、NRG1といったまれな遺伝子変異陽性肺がんへの画期的な検査法 BFAST試験:血液検体を用いたNGS解析の有用性を評価 分子標的治療には遺伝子検
血管新生阻害薬と免疫チェックポイント阻害薬とのシナジー効果に関する調
血管新生阻害薬と免疫チェックポイント阻害薬とのシナジー効果に関する調 主立ったドライバー変異のない進行非扁平上皮NSCLCにとっては、免疫チェックポイント阻害薬が登場したこ
EGFR TKIと血管新生阻害薬を併用するフロントライン治療
EGFR TKIと血管新生阻害薬を併用するフロントライン治療 EGFR遺伝子変異陽性肺がんの治療を受けていない患者には、第一世代のEGFR TKIに抗VEGF抗体のベバシズ
EGFR遺伝子変異陽性肺がん:あらゆる治療ラインにわたる至適治療にかかわる問題点
EGFR遺伝子変異陽性肺がん:あらゆる治療ラインにわたる至適治療にかかわる問題点 FLAURA試験:オシメルチニブを用いたファーストライン治療後のOS EGFR遺伝子変異陽