まれな遺伝子変異陽性患者への画期的かつ有効性などが確立した治療薬
CROWN試験:ファーストライン療法に用いるALK阻害薬のロルラチニブ
非常に強力で、血液脳関門を通過する、第三世代のALKチロシンキナーゼ阻害薬であるロルラチニブは、別の同阻害薬を使用したことのある、ALK融合遺伝子陽性進行NSCLC患者への治療薬として広く認められている。ⅢB期からⅣ期のALK融合遺伝子陽性NSCLC患者ほぼ300人を対象に、CROWN試験の第Ⅲ相ランダム化比較試験でファーストライン療法としてのロルラチニブをクリゾチニブと比較した。試験計画で定めた、対象患者300人に関する中間解析結果をSolomonらが報告した[1]。
同試験には23か国の104施設が参加している。被験薬のロルラチニブ群の149人にはロルラチニブ100 mgを1日1回投与し、対照薬のクリゾチニブ群の147人にはクリゾチニブ250 mgを1日2回投与した。CNS転移はあるが症状を伴わない患者は治療経験の有無を問わず試験に組み入れたが、どちらの群でもベースライン時点に約25%の患者に脳転移が認められた。なお、両群の間でのクロスオーバーは禁止した。盲検化した独立中央判定委員会が確認したPFSを主要評価項目にした。
PFSの判定のため中央値にしてロルラチニブ群で18.3か月、クリゾチニブ群で14.8か月追跡したところ、ロルラチニブの投与で進行や死亡のリスクが72%低下した(PFSの中央値は前者が判明せず、後者が9.3か月、HR:0.28、p<0.001)。12か月時点で増悪が認められなかったのはロルラチニブ群で78%、クリゾチニブ群で39%だった。事前に規定したすべてのサブグループに、ロルラチニブの効果が見られている。特に脳転移のある患者のHRが0.20だったことは、80%のリスク低下率と一致している。
頭蓋内奏効とCNS転移発生の防止
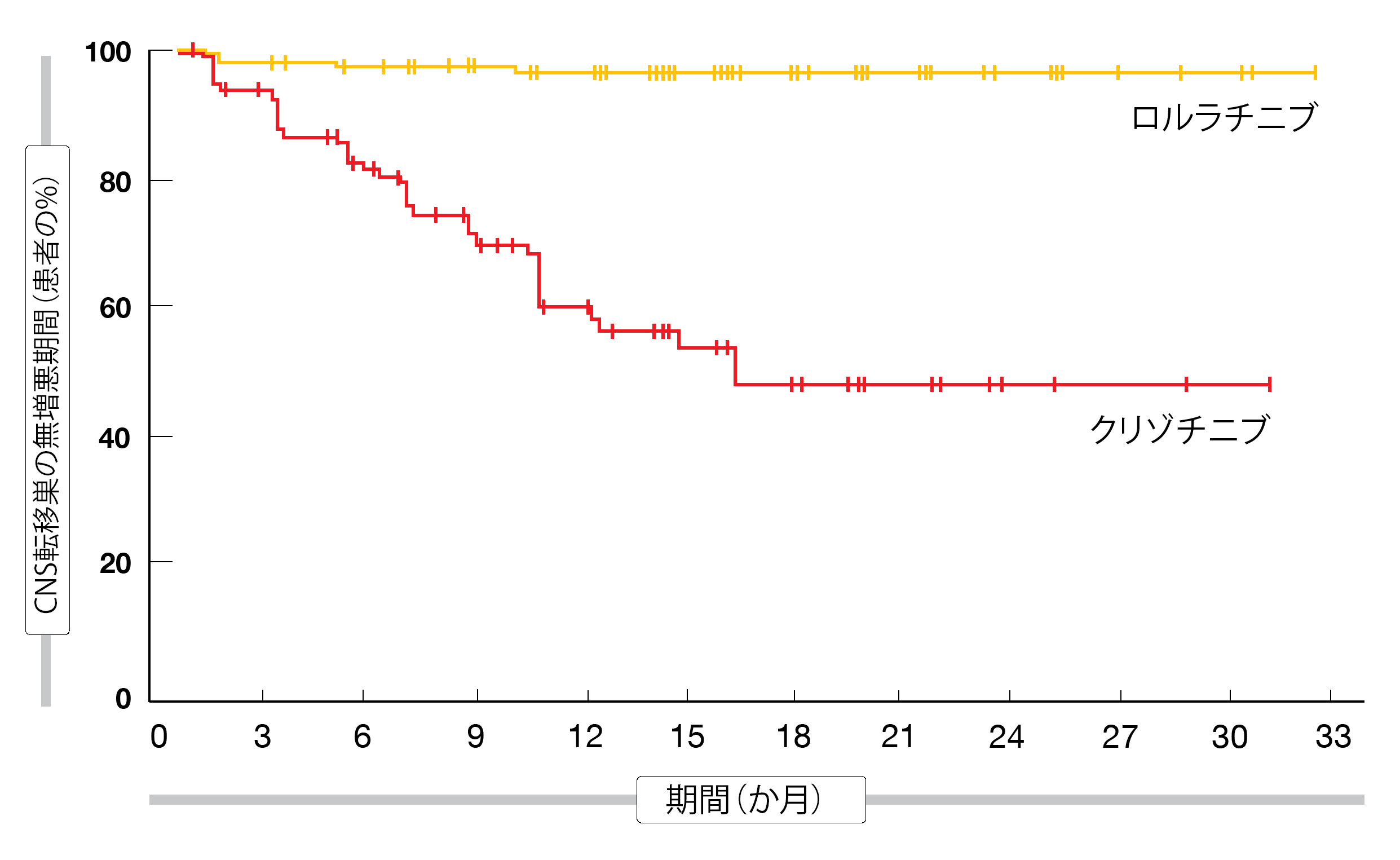
以上の効果だけにとどまらず、ロルラチニブ群ではORR(ロルラチニブ群は76%、クリゾチニブ群は58%、OR:2.25)と奏効期間の中央値(前者は判明せず、後者は11.0か月)に統計学的有意な効果がみられた。また、ロルラチニブ群では測定可能かどうかを問わずベースライン時に脳転移巣を認めた患者に、頭蓋内奏効率の高さがみられた(前者は66%、後者は20%、OR:8.41)。測定可能な脳転移巣がある患者の場合、クリゾチニブ群nの頭蓋内奏効率が23%であったのに対して82%にものぼり(OR:16.83)、頭蓋内完全奏効率の差には目を見張るものがあった(前者は71%、後者は8%)。CNS転移巣の無増悪期間もロルラチニブ群で統計学的有意に長くなり(前者は判明せず、後者は16.6か月、HR:0.07、 p<0.001、図1)、リスク低下率に換算すると93%となった。ロルラチニブ群では頭蓋内転移巣が進行する例が少なかったため、グラフの曲線の大きな開きが目に留まる。ロルラチニブには既存の脳転移巣の進行を遅らせるだけでなく新たな発生を予防する効果もあることを、以上の知見が示すこととなった。
中間解析を行った時点ではOS関連のデータがまだ出そろっていなかったが、HRが0.72とロルラチニブ群に良好な結果がみられた。ロルラチニブの安全性プロファイルはこれまでの試験報告の内容と一致していた。グレード3から4の有害事象はクリゾチニブ群よりも多くなったが、その大半は無症状ですぐに治療できる臨床検査値の異常だった。投与中止や休薬が必要になる有害事象については両群に統計学的有意差はなかった。
EORTC QLQ-C30調査票を用いた患者報告アウトカムを評価したところ、ロルラチニブ群でベースライン時点からのGQoL(全体のQoL) が統計学的有意かつ大幅に改善していた(p<0.01)。この改善は早い段階からみられ、18コースを行う間も続いていた。著者らが報告の際に触れたように、CROWN試験の成績はロルラチニブをALK融合遺伝子陽性の進行NSCLC患者へのファーストライン療法に使用できることの裏付けになった。なお、ロルラチニブの効果がみられなくなった後の治療に関するデータはなく、とりわけ他のALKチロシンキナーゼ阻害薬に関しての報告もなかった。
図1:ALK融合遺伝子陽性肺がん患者にロルラチニブまたはクリゾチニブをファーストラインで投与した場合のCNS転移巣の無増悪期間の比較
画期的医薬品であるKRAS阻害薬のソトラシブ
KRASがん遺伝子の発見から40年近くたつが、この遺伝子の阻害薬で承認を受けたものはいまだにない。しかし、NSCLC患者のおよそ13%からKRASG12Cの遺伝子変異を検出している[2~4]。
ソトラシブ(AMG 510)は非常に選択性の高い新規の画期的なKRASG12C阻害薬で、KRASG12C遺伝子変異陽性の固形がん患者に対して抗がん作用を発揮しつつ、安全性プロファイルは治療可能な内容になっている[4、5]。CodeBreaK100試験の第Ⅰ相多施設共同オープンラベル用量漸増・用量拡大試験で、KRASG12C遺伝子変異陽性の局所進行固形がん患者と転移性固形がん患者を対象に、標準治療後のソトラシブ使用について評価した。ソトラシブ960 mgの1日1回経口投与が、第Ⅱ相試験の推奨用量であることを見いだした。全体で13種類の固形がん患者129人が参加し、そのうち59人がNSCLC患者だった。
Hongらが、NSCLC患者に関するデータを本総会で報告した[6]。この群の患者のうちソトラシブ960 mgを投与したのは34人である。960 mg投与群の82.4%、NSCLC群全体の89.8%が以前にPD-L1阻害薬の投与を受けていた。NSCLC患者全員がプラチナ製剤ベースの化学療法を受けており、このうちの75%が2ライン以上の抗がん剤の全身療法を受けていた。
病勢コントロール率の高さが持続
試験責任医師らの評価によると、ORRは960 mg投与群が35.5%、NSCLC群全体が32.2%となった。奏効期間の中央値は10.9か月で、奏効に至った患者19人のうち10人にカットオフ時点でまだその状態が続いていた。病勢コントロール率については前者が91.2%、後者が88.1%となり、腫瘍の縮小がどの用量群にも認められた。NSCLC群全体のPFSの中央値は6.3か月だった。KRASG12Cの突然変異対立遺伝子の発現頻度、腫瘍組織でのPD-L1発現量、血漿中遺伝子変異量のすべての範囲で、ソトラシブの臨床活性が認められた。また、腫瘍組織に別の遺伝子変異(例:TP53、SMAD4、PTEN/PIK3CA、KEAP1、EGFR)が検出されていても臨床活性が示された。
同試験で報告のあった有害事象の大半は軽度もしくは中等度で、グレード3から4の治療関連有害事象の発現率は18.6%である。グレード3の有害事象
(トランスアミナーゼ値上昇)により1人だけ投与中止となった。なお、用量制限毒性も致死的な治療関連有害事象も発生していない。グレードを問わず発現率の上位を占めた有害事象は下痢、トランスアミナーゼ値上昇、疲労、悪心だった。かなりの治療を受けたことのある患者でもソトラシブの安全性プロファイルは良好で、病勢コントロール率が高い状態で持続したと著者らは強調して締めくくった。ソトラシブの単独療法や他の抗がん剤との併用療法についてCodeBreaK試験の追加試験で評価が続いている。
まれなEGFR遺伝子変異陽性肺がんへのアファチニブ投与
EGFR遺伝子変異陽性NSCLC患者のうちまれな変異が占める割合は7%から23%にのぼり、EGFR TKI療法への感受性に影響を及ぼしている[7]。珍しい遺伝子変異として知られているG719X、L861Q、S768Iなどに対して、不可逆的ErbBファミリー阻害薬のアファチニブが臨床活性を示している[8]。しかし、これ以外のまれなEGFR遺伝子変異陽性肺がんへのEGFR TKIの有効性に関する臨床データはわずかしかなく、人種ごとの変異頻度やアウトカムについての知識も限られている。そこで、まれな遺伝子変異陽性肺がんへのアファチニブの効果に関するデータベースにプール解析を行い、まれなEGFR遺伝子変異陽性NSCLC患者をアジア人(n=178)とそれ以外の人種(n=120)に分けて、アファチニブの有効性を評価した[9]。遺伝子変異の種類を、まれな中でも主な遺伝子変異(G719X、 L861Q、S768I)、遺伝子複合変異、エクソン20挿入変異、T790M変異、その他の変異の5つに大別した。
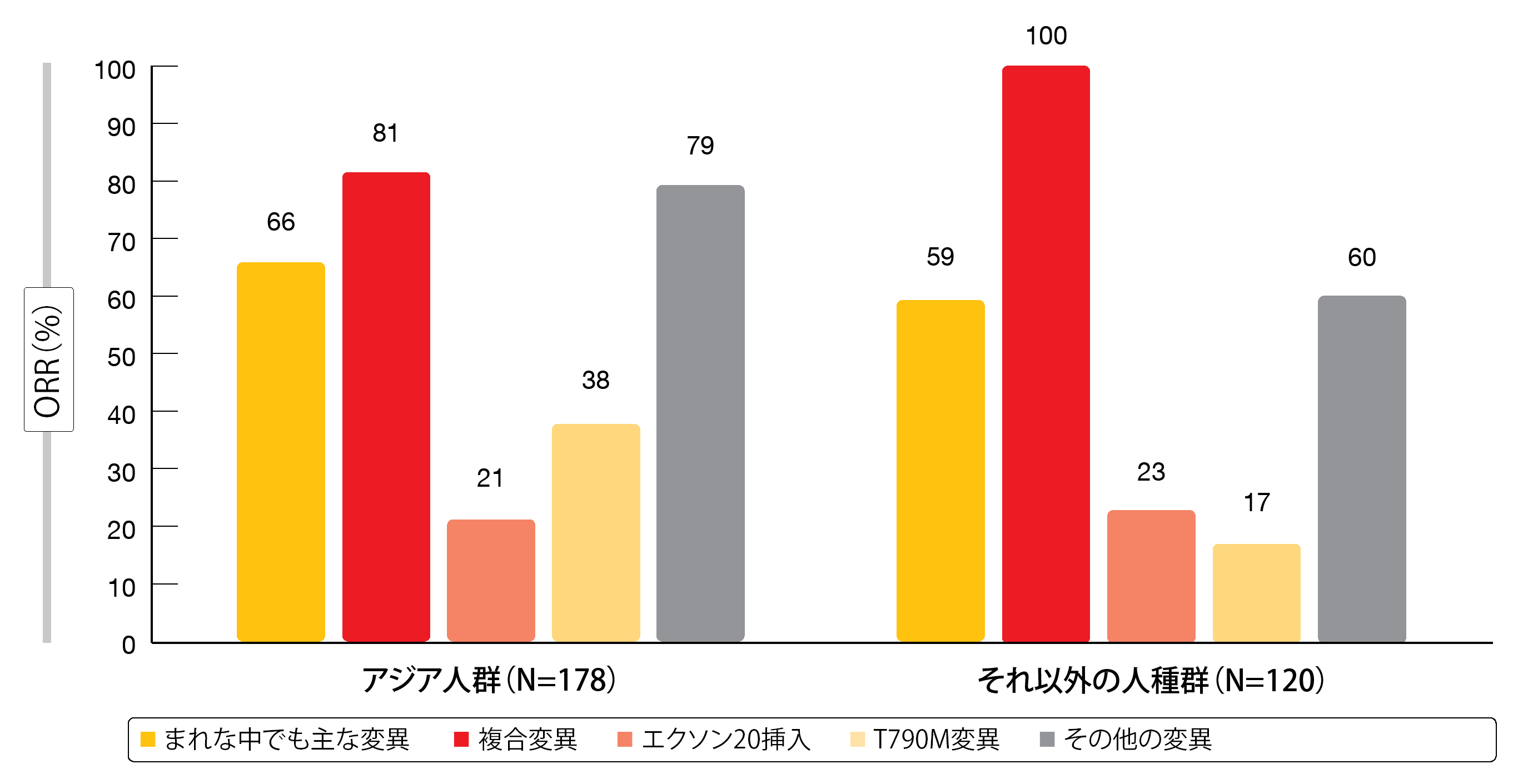
アジア人群では、アファチニブが適応になる、まれな中でも主な変異を検出した患者の割合が多くみられ(61.8%)、それ以外の人種群で最も多くみられたのはエクソン20挿入変異(39.2%)、次いでまれな中でも主な変異(35.0%)となった。アファチニブの臨床活性は両群にみられ、ORRの幅は17%から100%になった(図2)。エクソン20挿入変異患者では一定の割合の患者が治療に反応しており、サブグループ間に均一性のないことを現した。
奏効期間と治療成功期間を評価したところ、臨床活性が特に長く続いていたのはまれな中でも主な変異群や遺伝子複合変異群、その他の変異群だった。患者がアジア人かどうかに関係なく、まれな中でも主なEGFR遺伝子変異や遺伝子複合変異を検出した患者には、アファチニブをファーストラインで使用することを検討すべきだと、著者らは締めくくった。
図2:アファチニブ療法を受けた、まれなEGFR遺伝子変異陽性のアジア人群とそれ以外の人種群の奏効率
NRG1融合遺伝子を検出した患者への治療パターン
NRG1融合遺伝子変異が固形がん患者全体に認められる割合は0.2%だが、浸潤性粘液性肺腺がんなど特定の型では検出率が高く、31%と推測されている[10、11]。この遺伝子変異が陽性の固形がんを適応症に承認を得た治療薬はまだないものの、アファチニブ療法の効果が長期間持続することが複数の研究報告で示唆されているため[12~14]、この遺伝子変異を検出した患者への新しい治療の選択肢になる可能性がある。
実臨床での後ろ向きのフィージビリティ調査を行って、アファチニブ療法を受けたことのある米国在住のNRG1融合遺伝子陽性患者と、アファチニブ療法を受けたことはなく他の全身療法を受けた同患者を特定した[15]。同調査を行った目的は、解析対象になるNRG1融合遺伝子陽性固形がん患者を評価すること、そして治療パターンと検査法について理解を深めることである。合計で108人が対象になり、そのうち67人がアファチニブ療法を受けたことがあった。
複数の種類の固形がんでNRG1融合遺伝子を検出したというこれまでの知見が、今回のデータで裏付けられた[10]。アファチニブ療法群とその他の全身療法群の両方で最も多い種類はNSCLCとなり(前者は40%、後者は56%)、次いで消化器がんと乳がんになった。NRG1遺伝子の融合パートナー遺伝子の上位を占めたのは、SDC4、 CD74、ATP1B1で、その検出に最も多く行ったのはmRNAシーケンスだった。アファチニブはセカンドラインで投与することが多く、ファーストラインには他の治療薬を用いることが多かった。
以上の知見が、同調査よりも規模の大きい、図表を基にした後ろ向きコホート研究でのアウトカム評価を必要とする根拠になると、著者らは述べている。 NRG1融合遺伝子陽性固形がん患者へのアファチニブの使用については、 Drug Rediscovery Protocol(既存の分子標的薬を再評価する)試験(DRUP、 NCT02925234)やTargeted Agent and Profiling Utilization Registry(同薬の感受性など実臨床に関する)試験(TAPUR、NCT02693535)といった前向き試験で調査中である。
参考文献:
- Solomon B et al., Lorlatinib vs crizotinib in the first-line treatment of patients with advanced ALK-positive non-small cell lung cancer: results of the phase 3 CROWN study. ESMO 2020, LBA2
- Biernacka A et al., The potential utility of re-mining results of somatic mutation testing: KRAS status in lung adenocarcinoma. Cancer Genet 2016; 209(5): 195-198
- Wiesweg M et al., Impact of RAS mutation subtype on clinical outcome-a cross-entity comparison of patients with advanced non-small cell lung cancer and colorectal cancer. Oncogene 2019; 38(16): 2953-2966
- Canon J et al., The clinical KRAS(G12C) inhibitor AMG 510 drives anti-tumour immunity. Nature 2019; 575(7781): 217-223
- Govindan R et al., Phase I study of AMG 510, a novel molecule targeting KRAS G12C mutant solid tumors. Ann Oncol 2019; 30(suppl_5): v159-v193
- Hong DS et al., Durability of clinical benefit and biomarkers in patients with advanced non-small cell lung cancer treated with AMG 510 (sotorasib): CodeBreaK 100. ESMO 2020, 12570
- Kohsaka S et al., A method of high-throughput functional evaluation of EGFR gene variants of unknown significance in cancer. Sci Transl Med 2017; 9(416): eaan6566
- Yang JCH et al., Clinical activity of afatinib in patients with advanced non-small-cell lung cancer harbouring uncommon EGFR mutations: a combined post-hoc analysis of LUX-Lung 2, LUX-Lung 3, and LUX-Lung 6. Lancet Oncol 2015; 16(7): 830-838
- Yang JCH et al., Afatinib in Asian and non-Asian patients with EGFR mutation-positive NSCLC harboring uncommon mutations. ESMO 2020, 1341P
- Jonna S et al., Detection of NRG1 gene fusions in solid tumors. Clin Cancer Res 2019; 25(16): 4966-4972
- Trombetta D et al., Frequent NRG1 fusions in Caucasian pulmonary mucinous adenocarcinoma predicted by Phospho-ErbB3 expression. Oncotarget 2018; 9(11): 9661-9671
- Gay ND et al., Durable response to afatinib in lung adenocarcinoma harboring NRG1 gene fusions. J Thorac Oncol 2017; 12(8): e107-e110
- Jones MR et al., Successful targeting of the NRG1 pathway indicates novel treatment strategy for metastatic cancer. Ann Oncol 2017; 28(12): 3092-3097
- Cadranel J al., Therapeutic potential of afatinib in NRG1 fusion-driven solid tumors: a case series. Oncologist 2020 Aug 27. DOI: 10.1634/theoncologist.2020-0379
- Gajra A et al., A real-world feasibility study of patients with solid tumours harbouring NRG1 fusions. ESMO 2020, 1956P
© 2020 Springer-Verlag GmbH, Impressum