初期の肺がん:各治療法の注目すべき知見
術後放射線治療に関する第Ⅲ相試験のデータ
NSCLCを完全に切除した患者への術後放射線治療(術後照射、PORT)は長年の間、議論の的になっている。術後照射の有効性を証明する確実なデータが限られているため、患者の選択基準、術後(術前)補助化学療法、手術、放射線治療に関してこの20年間にさまざまな変化が起きたことで、この療法を行うことがさらにためらわれるようになった。そこで、NSCLCを完全切除したTNM分類がN2の患者に対して、縦隔リンパ節への現行の術後照射が果たす役割を評価するべく、LungART試験の第Ⅲ相大規模ランダム化比較試験を行うことになった。フランス、英国、ドイツ、スイス、ベルギーの医療機関で、線量54 Gyの術後原体照射を5.5週間にわたり行う群(n=252)と術後照射をしない対照群(n=249)に患者をランダムに割り付けた。
両群とも96%の患者が術後(術前)補助化学療法を受けていた。主にPET検査結果をもとに患者を選択したが、およそ40%にTNM臨床分類のN2のリンパ節転移が見つかった。pTNM分類やypTNM分類を用いると、それぞれの群で縦隔リンパ節の1領域だけに転移のある例が45%に、2領域以上に転移のある例が52%にのぼった。
どちらの群でも約80%の患者が肺葉切除術を受けていた。術後照射群に行ったのは主に三次元原体照射(3D-CRT)で(89%)、11%には強度変調放射線治療を行った。同試験は、術後(術前)補助化学療法を受け、主にPET検査結果をもとに選んだ患者のNSCLCの完全切除後に行う術後照射を評価する、ヨーロッパ初のランダム化比較試験になった。この試験の主要評価項目は無病生存期間(DFS)とした。
心毒性・肺毒性の増加
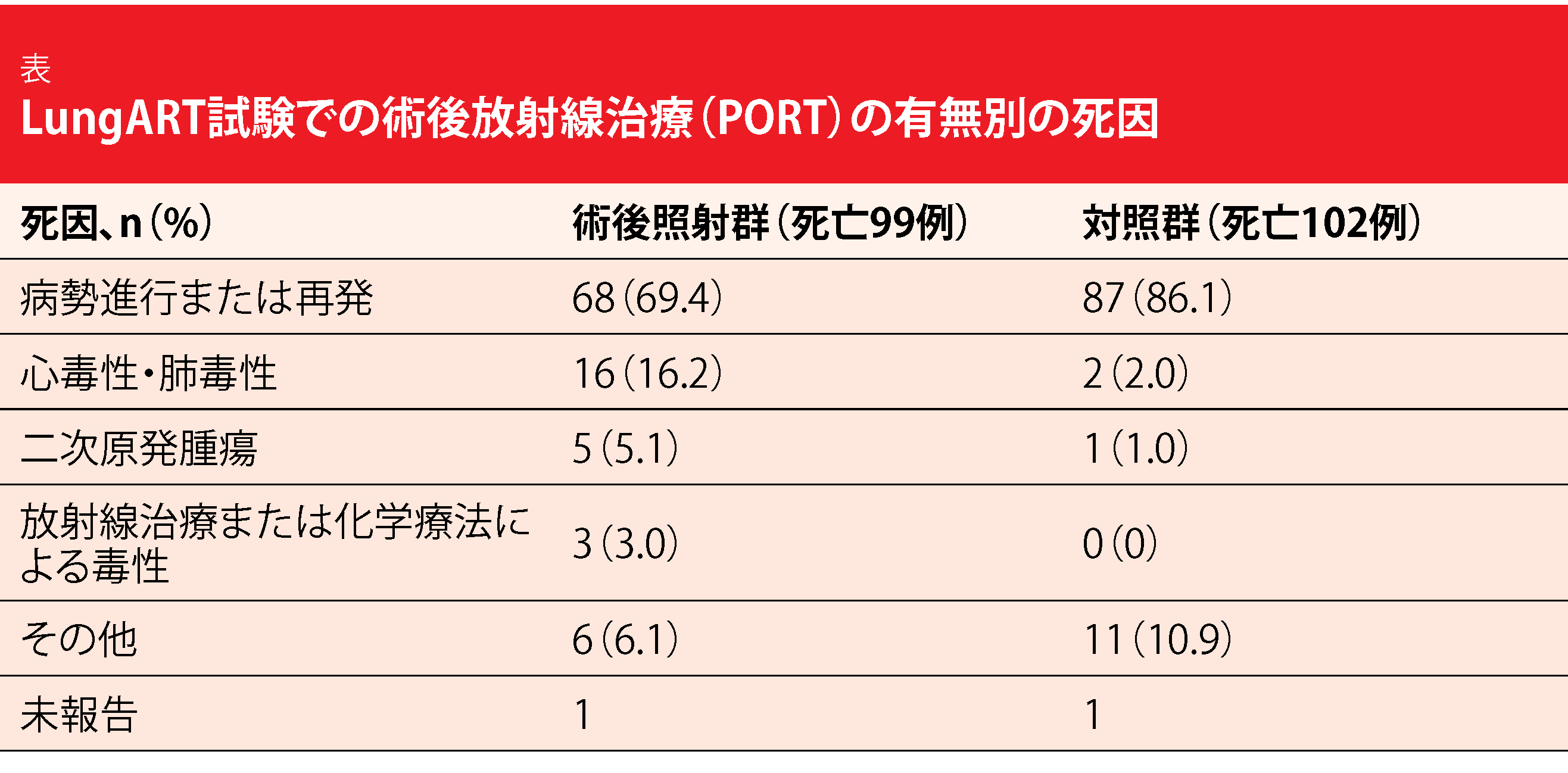
LungART試験の主要評価項目についてLe Péchouxらが本総会で報告した[1]。中央値にして4.8年追跡したところ、DFSの中央値は術後照射群で30.5か月、対照群で22.8か月となり、照射の利点には統計学的有意性がないのと同じことになった(HR:0.85、p=0.16)。3年時点のDFSは前者が47.1%、後者が43.8%となり、どちらとも予想以上の結果が出た。初めて認められた事象が縦隔リンパ節への転移という患者が術後照射群(25.0%)よりも対照群で多くなった(46.1%)ものの、術後照射群では死亡が初めての事象となることが多くなった(前者は14.6%、後者は5.3%)。OSは両群に差異はなく、3年生存率は前者が66.5%、後者が68.5%で、総死亡率は両群でほぼ同等だった(前者は39.6%、後者は41.5%)。一方、対照群では進行や再発が死因となる患者が多くなったのに対して、術後照射群では死因が心毒性・肺毒性となる患者が多くなった(表)。
予想したとおり、初期からグレード3や4の毒性が術後照射群で多く生じ、後期についても同じだった(前者は14.6%、後者は8.9%)。ランダム割り付けから3か月以内に術後照射群の3人が毒性(具体的には心肺停止、間質性肺炎、感染性間質性肺炎)で死亡したのに対して(1.2%)、対照群では0人だった。後期に発生したグレード5の毒性については両群に差異はなかった(前者は1.2%、後者は0.8%)。グレード3または4の心毒性・肺毒性が少なくとも1回生じたのは、術後照射群で26人(10.8%)、対照群で12人(4.9%)だった。二次がんが術後照射群の11.2%に、対照群の7.2%に発生したが、特に多かったのは肺の二次がんだった(前者は39.3%、後者は22.2%)。以上のことから、二次がんの発生部位、注目している事象の評価の妨げになる別の事象が原因で治療不成功になるパターン、その他の要因を深く分析する必要があることに疑いの余地はない。
全般的に、対照群に比べれば術後照射群で縦隔リンパ節に転移する例がほぼ半分に減ったとはいえ、毒性の発生が増加したことを考えると、ⅢA期のNSCLCを完全に切除したN2症例の患者全員に原体照射を標準治療として行うことは勧められない。この試験で得たデータをさらに解析する予定になっている。
ADAURA試験:中枢神経系の再発リスクが82%減少
ADAURA試験の第Ⅲ相二重盲検試験では、腫瘍を完全に切除したIB期からⅢA期のEGFR遺伝子陽性NSCLCの患者に、第三世代のEGFR TKIのオシメルチニブを術後補助療法として投与したところ、DFSに統計学的有意性および臨床的意義が非常に高い改善が認められた[2]。同試験でみられたCNSを含む再発の種類に事前に設定した方法で探索的データ解析を行った結果を、本総会で坪井らが報告した[3]。EGFR遺伝子変異陽性がんでは、局所(領域)進行した症例よりも遠隔再発した症例の方の予後が悪くなり、遠隔再発の多い部位がCNSであるためその重要性が高いことから、NSCLCを完全切除した患者に関しては再発の種類を十分に考慮する必要がある。オシメルチニブの脳の暴露量は他のEGFR TKIに比べて臨床的意義のある多さになり、血液脳関門の透過性がより高いことも示されている[4~6]。
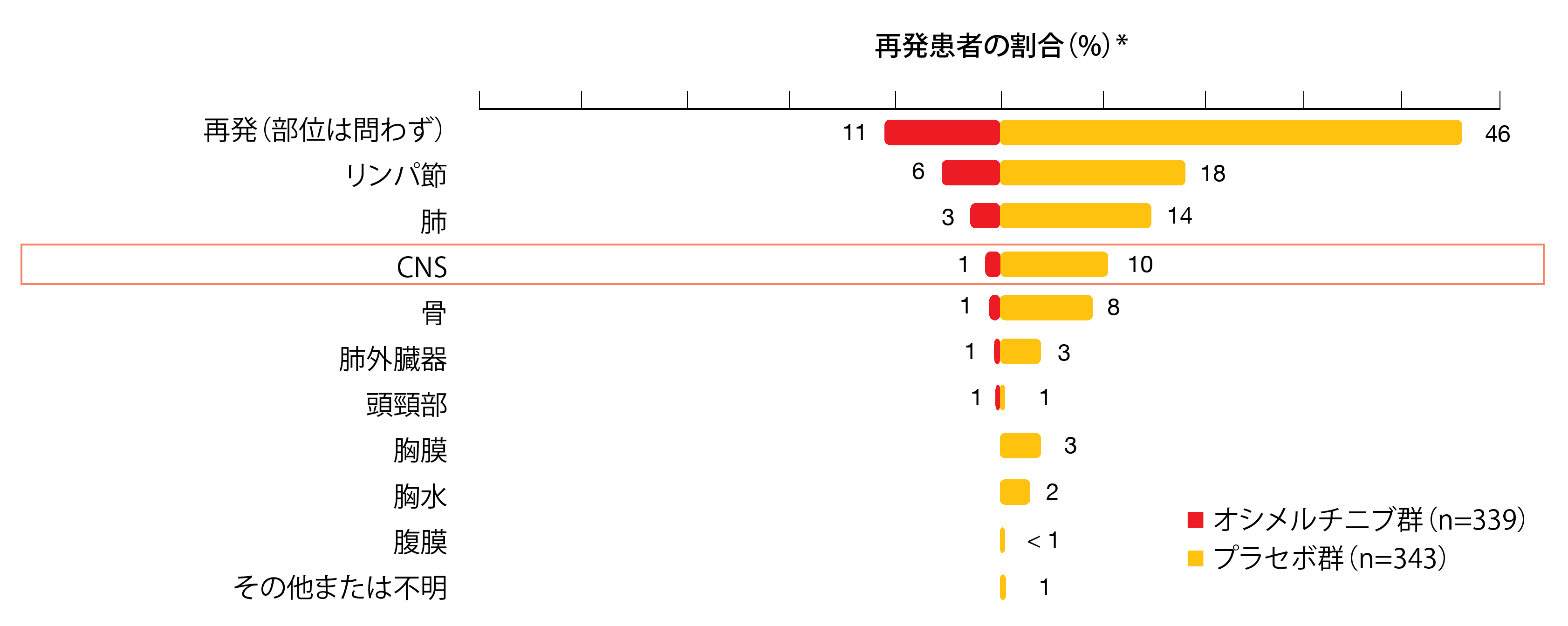
同試験のオシメルチニブ群とプラセボ群で再発または死亡した患者の割合は、合計でそれぞれ11%と46%になった。オシメルチニブ群の再発患者の内訳をみると、局所(領域)再発が62%と大部分を占め、遠隔再発は38%だった。一方、プラセボ群ではこの割合が反対になった(局所(領域)再発は39%、遠隔再発は61%)。CNSに再発したのがオシメルチニブ群ではわずか1%であったのに対して、プラセボ群では10%にのぼった(図1)。オシメルチニブ群のCNSへの再発リスクや死亡リスクはプラセボ群のそれに比べて82%減少した(HR:0.18、p<0.0001)。Kaplan-Meier推定量を見ると、オシメルチニブ群のCNSへの再発に関する累積罹患率が一貫して低くなっていた。18か月時点でCNSでの再発もなく死亡していない患者に、CNSに再発する条件付き確率は、オシメルチニブ群が1%未満、プラセボ群が9%である。著者らが報告の際に強調したように、腫瘍を完全に切除したIB期、Ⅱ期、ⅢA期のEGFR遺伝子陽性NSCLCの患者へのオシメルチニブの術後補助療法が、非常に効果の高い、現行の治療法を変える存在になる可能性が試験データによって強まった。
図1:ADAURA試験:再発群の再発部位
アテゾリズマブの術前補助療法:PRINCEPS試験
NSCLC患者に免疫チェックポイント阻害薬を術前投与すると、病理学的奏効率が17%~45%になることがみられている[7、8]。第Ⅱ相PRINCEPS試験では、
腫瘍径が2 cm以上あるⅠ期からⅢA期のNSCLC患者にアテゾリズマブを単独投与する術前補助療法について調査した[9]。PD-L1の発現状況を問わずに選んだ患者30人にアテゾリズマブ1,200 mgを1回点滴静注し、約4週間後にあたる21日目から28日目に手術を行った。同試験の実施地域のガイドラインに応じて、術後補助化学療法と場合によっては放射線治療も行うことを認めた。
2か月間の忍容率(具体的には術前補助療法の開始日から手術実施から1か月後の間に、主な毒性も合併症も生じなかった患者の割合)を主要評価項目とした。主な毒性と合併症を、手術を15日以上延期させる原因になる治療関連毒性、アテゾリズマブの投与後2か月以内に生じるグレード3以上の毒性、主な術後合併症、アテゾリズマブの投与日から術後30日までの間にアテゾリズマブが関与するすべての死亡、早期の病勢進行による手術中止とした。
臨床評価項目以外にも、切除して間もない組織とその際に採血した血液のがん微小環境における獲得免疫、リキッドバイオプシーで特定した循環免疫細胞マーカー、切除時・投与開始前・病勢進行時の分子プロファイリングなどを調査対象にした。ベースライン時のPD-L1の発現量が1%未満で陰性になった患者は62%になったが、1%以上の患者は21%となり、必要に高い発現量(50%以上)が17%の患者にみられた。
手術日に大幅な延期なし
アテゾリズマブの投与開始から中央値にして24日後に手術を行った。注目すべきは15日以上手術を延期した患者が一人もいなかったことである。全患者が肺葉切除術を受け、R0切除を行えた患者は97%になり、R1切除となったのは3%だった。術後照射を29.7%の患者に行った。術後1か月以内に患者30人のうち7人(23%)に合併症が起き、心房細動と感染症が主だった。この合併症の発生率は、今回の患者集団で発生すると予測した率と一致していた。なお、グレード4から5の合併症は発生していない。
RECISTガイドライン1.1版の基づくと、7%の患者が部分奏効に達した。14%の患者に病理学的奏効(残存腫瘍細胞が10%未満と定義)が、41%の患者に50%以上の病理学的部分奏効(残存腫瘍細胞が50%未満と定義)がみられた。一方、病理学的完全奏効がみられた患者はいなかった。オクトレオチド検査や18F-FDG PET/CT検査の所見に、病理学的奏効とRECISTガイドライン1.1版に基づく奏効率との相関性も、代謝変動との相関性もないことが、解析で示された。しかし、腫瘍細胞に占めるPD-L1陽性細胞の増加とより顕著な病理学的退縮につながりがみられたことから、病理学的奏効とベースライン時のPD-L1発現量に相関性のあることを研究者らが見いだし、定量解析でこの相関性を確認することができた。切除後4時間未満の組織への免疫浸潤の特徴も調べることになった。フローサイトメトリーのデータを解析したところ、リンパ球でのPD-L1の発現とTIGIT発現にはっきりとした相関性が認められた。
術前に投与するアテゾリズマブが1コースなら安全性も高く、手術の大幅な延期の原因にもならないと、著者らは結論づけた。トランスレーショナルリサーチの対象になる術前補助療法を受けない患者と対照群に入る患者30人を、現在募集している。対照群に入る患者の募集は完了した時点で、血液と採取して間もない腫瘍組織の浸潤免疫細胞の特徴(immune contexture)について最終解析を始めることになっている。
PACIFIC試験開始から4年後にみられた前例のないOSの改善
切除不能なⅢ期の局所進行NSCLC患者で、プラチナ製剤ベースの化学放射線療法実施後に進行が見られなかった患者にデュルバルマブを用いる地固め療法が有効であったことが、PACIFIC試験の第Ⅲ相二重盲検ランダム化比較試験で示された。一次解析結果によると、PFS(デュルバルマブ群は16.8か月、プラセボ群は5.6か月、HR:0.52、p<0.001)とOS(前者は17.2か月、後者は5.6か月、HR:0.68、p=0.0025)の両方に改善がみられた[10、11]。また、デュルバルマブ群の安全性プロファイルは治療可能な内容で、患者報告アウトカムへの悪影響もみられなかった[10~12]。化学放射線療法後のデュルバルマブ投与が切除不能なⅢ期のNSCLC患者への標準治療になりうることが、こういった知見から証明された。
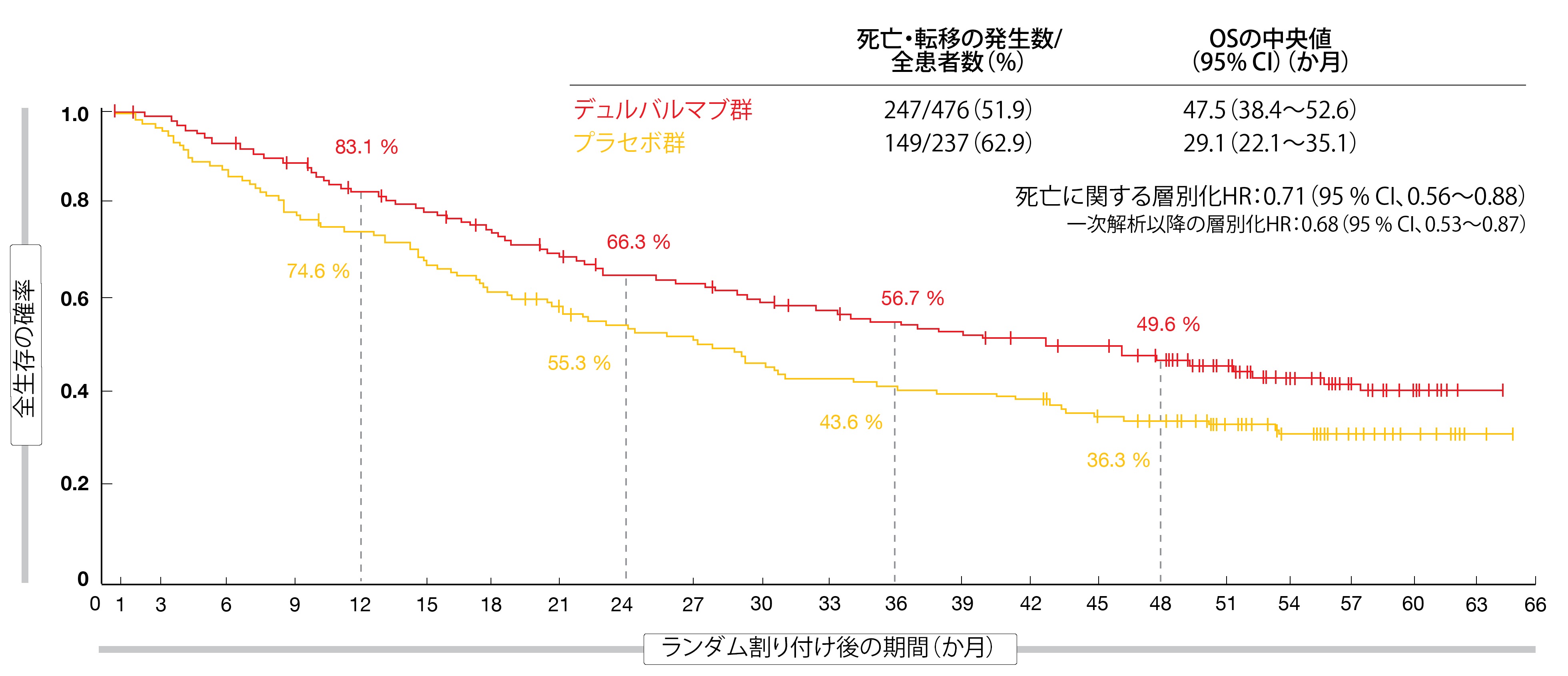
同試験で最後の患者をランダム割り付けしてからおよそ4年後に得たOSとPFSの最新解析データを、Faivre-Finnらが発表した[13]。今回の知見のひ
とつは、デュルバルマブ群のOSの中央値の初回推定値が47.5か月で、プラセボ群に比べて死亡率が29%低下したことを意味する(プラセボ群は29.1か月、HR:0.71、図2)。48か月時点のOSは前者が49.6%、後者が36.3%だった。PFSに関する最新に解析データからは、進行と死亡のリスクが45%減少したことが示され(前者は17.2か月、後者は5.6か月、HR:0.55)、48か月時点のPFSの推定値は35.3%と19.5%になった。EGFR遺伝子変異陽性患者を除いて、事前に決めていたすべてのサブグループの患者のOSとPFSにデュルバルマブ投与のメリットが得られたが、サブグループの患者数が少なく、探索的データ解析の特性もあり、はっきりと結論づけることはできなかった。PD-L1関連の全サブグループのPFSがデュルバルマブ投与により改善し、PD-L1陽性患者のOSにも延長効果があったのに対して、PD-L1が発現していない患者のOSにはデュルバルマブによる延長効果がないように思われた。ただ、この解析は予定外の事後解析で有効性の検出力を十分に確保できなかったため、限界があることを考慮する必要がある。
化学放射線療法実施後に行ったデュルバルマブを用いた地固め療法によって、PFSの改善とOSの延長効果が4年後でも確実に続いていることがおおむね認められた。免疫チェックポイント阻害薬と化学放射線療法の併用療法を複数の臨床試験で調査しており、場合によっては切除不能なⅢ期のNSCLC患者への治療の在り方がさらに変わるきっかけになるのかもしれない。
図2:PACIFIC試験におけるデュルバルマブ地固め療法群とプラセボ群の長期生存率の比較
参考文献:
- Le Péchoux C et al., An international randomized trial comparing post-operative radiotherapy (PORT) to no PORT, in patients with completely resected NSCLC and mediastinal N2 involvement. ESMO 2020, LBA3_PR
- Herbst RS et al., Osimertinib as adjuvant therapy in patients with stage IB–IIIA EGFR mutation positive NSCLC after complete tumor resection: ADAURA. J Clin Oncol 38: 2020 (suppl; abstr LBA5)
- Tsuboi M et al., Osimertinib adjuvant therapy in patients with resected EGFR mutated NSCLC (ADAURA): CNS disease recurrence. ESMO 2020, LBA1
- Colclough N et al., Preclinical comparison of the blood brain barrier permeability of osimertinib (AZD9291) with other irreversible next generation EGFR TKIs. Eur J Cancer 2016; 69: S28
- Ballard P et al., Preclinical comparison of osimertinib with other EGFR-TKIs in EGFR-mutant NSCLC brain metastases models, and early evidence of clinical brain metastases activity. Clin Cancer Res 2016; 22(20): 5130-5140
- Vishwanathan K et al., Osimertinib displays high brain exposure in healthy subjects with intact blood-brain barrier: a microdose positron emission tomography study with 11C-labelled osimertinib. Cancer Res 2018; 78(13 Suppl): CT013
- Forde PM et al., Neoadjuvant PD-1 blockade in resectable lung cancer. N Engl J Med 2018; 378: 1976-1986
- Cascone T et al., Neoadjuvant nivolumab or nivolumab plus ipilimumab for resectable non-small cell lung cancer: Clinical and correlative results from the NEOSTAR study. J Clin Oncol 37, 2019 (suppl; abstr 8504)
- Besse B et al., Neoadjuvant atezolizumab for resectable non-small cell lung cancer: results from the phase II PRINCEPS trial. ESMO 2020, 12150
- Antonia SJ et al., Durvalumab after chemoradiotherapy in stage III non-small-cell lung cancer. N Engl J Med 2017; 377(20): 1919-1929
- Antonia SJ et al., Overall survival with durvalumab after chemoradiotherapy in stage III NSCLC. N Engl J Med 2018; 379(24): 2342-2350
- Hui R et al., Patient-reported outcomes with durvalumab after chemoradiotherapy in stage III, unresectable non-small-cell lung cancer (PACIFIC): a randomised, controlled, phase 3 study. Lancet Oncol 2019; 20(12): 1670-1680
Faivre-Finn C et al., Durvalumab after chemoradiotherapy in stage III NSCLC: 4-year survival update from the phase PACIFIC trial. ESMO 2020, LBA49
© 2020 Springer-Verlag GmbH, Impressum