小細胞がん患者への治療を成功に導く決め手
CASPIAN試験における予測因子
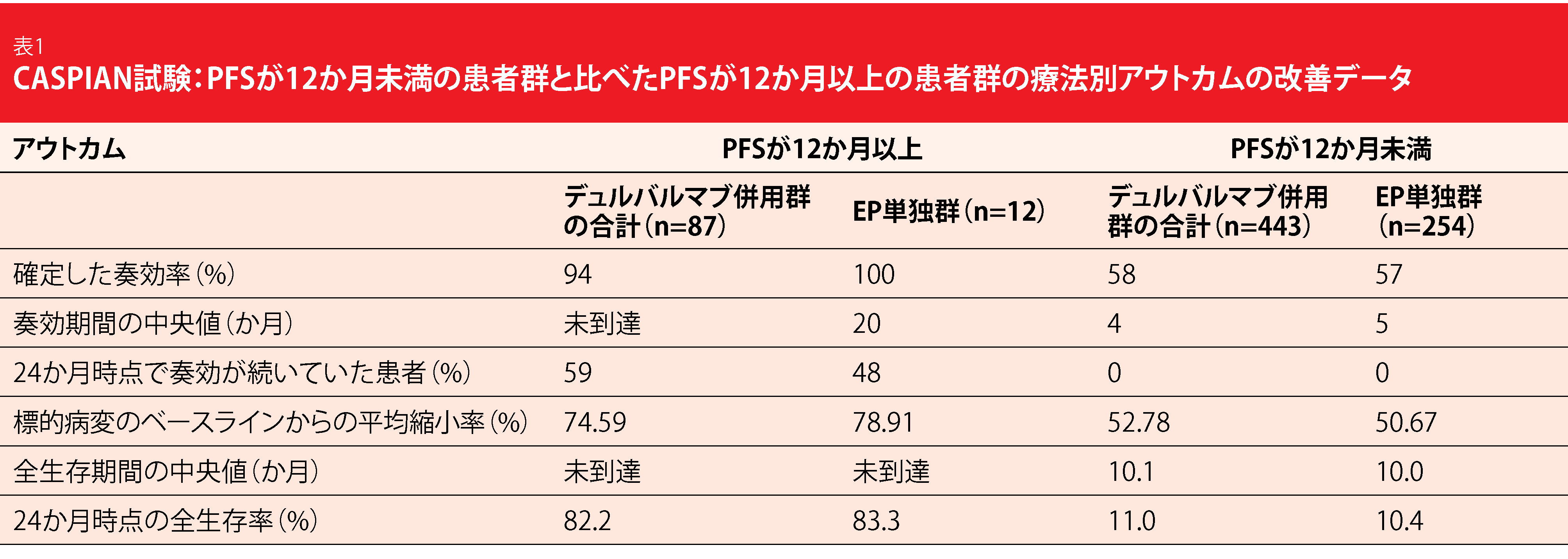
CASPIAN試験の第Ⅲ相オープンラベルランダム化比較対照試験で進展型小細胞肺がん(ES-SCLC)患者を対象に、ファーストラインのデュルバルマブ+シスプラチンとエトポシド(EP)に場合によってはトレメリムマブを追加する併用療法をEP単独療法と比較検討した。EP単独療法群に比べてデュルバルマブ+EP併用療法群でOSが統計学的有意に改善した(HR:0.73、p=0.0047)[1]。この効果は中央値にして2年以上たった時点でも続いていた(併用療法群は12.9か月、単独療法群は10.5か月、HR:0.75、p=0.0032)[2]。24か月時点で生存していた患者の割合は前者で22.2%、後者で14.4%だった。長期間効果が続いている患者のアウトカムを予測できるような臨床的特徴のほか、腫瘍組織の遺伝子変異量(tTMB)および有効性を特定するために、探索的データ解析を行った[3]。12か月以上のPFSを暫定的なしきい値にして、治療を受けている患者のアウトカムを予測できる可能性のある因子を特定することにした。
デュルバルマブ+EP併用療法群でPFSが12か月以上になったのは265人のうち45人(17%)、デュルバルマブ+トレメリムマブ+EP併用療法群では266人のうち42人(15.8%)だった。両群のPFSが12か月以上になった患者を合計すると(531人のうち87人、16.4%)、EP単独療法でこうなった患者の人数(266人のうち12人、4.5%)の3倍を超えた。全群でPFSが12か月以上になった患者を12か月未満になった患者と比べると、ORR、奏効期間、最大腫瘍縮小率、OSが改善していた(表1)。2年生存率は75%を超えており、今までにない長期有効性の高さを示した。
ただ、長期間効果が続いている患者に特有の臨床的特徴はみつからなかった。全群を見渡してみてもPFSが12か月以上になった患者には、良好なアウトカムにつながる従来型の予測因子(ECOGパフォーマンスステータスが0で脳転移も肝転移もない)が多くあることがみられたが、臨床的に意義のある割合の患者に予後不良の予測因子も同時にみられた。シスプラチンやその他の抗がん剤投与の点では、PFSが12か月以上と未満の患者に差異はなかった。デュルバルマブ+(トレメリムマブ)EP併用療法群をEP単独療法とどのカットオフ時点で比べても、tTMBはOSの改善を予測する因子にも連続変数にもなっていなかった。PFSが12か月以上の患者群でのデュルバルマブの投与量の多さと、免疫関連有害事象の発現率の高さに関わらず、重篤な有害事象であり、投与中止の原因にもなるグレード3から4の有害事象の発現率は、PFSが12か月未満の患者群での発現率とほぼ同じだった。デュルバルマブ投与により長期有効性が得られるかどうかを予測する因子について、さらに調査が続いている。
IMpower133試験
進展型小細胞肺がんへのファーストライン療法としてのアテゾリズマブ+カルボプラチン/エトポシド併用療法を、IMpower133試験の第Ⅲ相二重盲検プラセボ対照ランダム化比較試験で評価した。プラセボ+カルボプラチン/エトポシド療法群に比べると、アテゾリズマブ併用療法群でOS(併用療法群は12.3%、プラセボ群は10.3か月、HR:0.70、p=0.007)とPFS(前者は5.2か月、後者は4.3か月、HR:0.77、p=0.02)が改善した[4]。さらに追跡したところアテゾリズマブ併用療法群でOSの延長効果が続いており、12か月時点、18か月時点、24か月時点の生存率も上昇していたことから、同併用療法群が新たな標準治療になりうることが証明された[5]。生存期間が延長した患者の特性に関するデータが限られたため、ランダム割り付けから18か月以上生存していた患者を長期生存者(LTS)として、その特性に探索的データ解析を行った結果をLiuらが報告した[6]。
LTSが占める割合を調べると、プラセボ群(191人のうち39人、20.4%)よりもアテゾリズマブ併用療法群(182人のうち61人、33.5%)でその割合が大きくなっていた。患者特性(性別、年齢、ECOGパフォーマンスステータス)ごとに調べた場合、LTSに該当する患者ほどプラセボ+カルボプラチン/エトポシド療法ではなくアテゾリズマブ併用療法を受けていることがわかった。疾病負荷の大きさと関連することの多い疾患特性(転移部位の数、肝転移または脳転移、LDH値の上昇、最大腫瘍径を合計した長さ)にも同じことが当てはまり、疾患特性を個別にみてもLTSほどアテゾリズマブ併用療法を受けていた。
バイオマーカーの解析結果によると、複数のカットオフ日で血中のTMBとPD-L1の発現量が高値を示すことと、長期生存の可能性との間に相関性はなかった。従って、患者の選択にはTMBとPD-L1の発現状態に有用性はないと思われる。多変量解析であるCox回帰分析を行ったところ、パフォーマンスステータスの悪化、LDH値上昇、最大腫瘍径の合計値だけが、予後不良の予測因子であることを確認した(表2)。多変量モデルのその他の変数を補正するとOSへのアテゾリズマブ併用療法の影響がよりはっきりとし、統計学的有意なハザード比が0.71となった。著者らが結論づけたように、評価した患者特性や疾患特性に関わらず、アテゾリズマブ+カルボプラチン/エトポシド併用療法がES-SCLC患者に効果をもたらす可能性があり、未治療の同患者への標準治療になりうることを今回の探索的データ解析で確認した。
STIMULI試験:免疫療法を用いる地固め療法
限局型小細胞肺がん(LS-SCLC)には、化学放射線療法(CRT)とその後の予防的全脳照射(PCI)が根治療法の標準になっている。試験番号ETOP/IFCT 4-12のSTIMULI試験の第Ⅱ相国際共同ランダム化比較試験は、CRTとPCIの実施後に病勢が進行しなかったLS-SCLC患者(Ⅰ期からⅢB期)へのニボルマブとイピリムマブを用いる地固め療法の優越性を示すことを目的にした[7]。導入期にはニボルマブ1 mg/kgとイピリムマブ 3 mg/kgの3週間隔投与を4コース行い、維持期にはニボルマブ 240 mgの隔週投与を最長で12か月間行った。対照群の患者にはこの後の治療を行わなかった。合計で153人の患者をニボルマブとイピリムマブの地固め療法群(n=78)と観察群(n=78)のどちらかにランダムに割り付けた。事務処理の都合上、患者登録を早めに打ち切った。また、LS-SCLCが特定できた患者数が予想に反して少なく、患者の参加中止率(CRTとPCIを完遂できなかった患者の率)も高かった。こういったことが原因で、最終的に、もう1つの主要評価項目をもともとの試験デザインに入れた後のPFSを主要評価項目に設定した。
同試験の主要評価項目を達成することはできなかった(PFSの中央値は地固め療法群が10.7か月、観察群が14.5か月、HR:1.02、p=0.93)。地固め療法群の治療開始から中止までの期間の中央値は1.7か月と短く、12か月時点で治療を続けていた患者はわずか15.6%だった。何度か曲線が交差するなどPFSの曲線が同じようなパターンになったのは、このことで説明がつくだろう。
特定のサブグループにもたらした効果
サブグループ解析を行ったところ、ECOGパフォーマンスが1の患者と放射線治療の分割照射を1日2回受けた患者には、ニボルマブとイピリムマブの地固め療法でPFSに改善がみられた(HRは前者が0.67、後者が0.63)。解析の時点では地固め療法群はOSの時期に達しておらず、観察群は31.6か月となったが、統計学的有意差は認められなかった(HR:1.06、p=0.83)。繰り返しになるが、ECOGのPSが1の患者(HR:044)と放射線治療を1日2回受けた患者(0.41)以外に、女性患者(0.34)にも地固め療法の効果がみられた。
両群で病勢進行が同じようなパターンになっていた。地固め療法群で治療失敗の最大原因になったのは毒性で、観察群では病勢進行になった。グレード3から5の治療関連有害事象が併用療法群の51%、観察群の25%に起き、地固め療法群ではこの大半(49%)が投与中止に至った。あらゆる有害事象で特に発現率が高かったのは疲労、食欲不振、下痢、嘔吐、間質性肺炎、悪心、咳だった。
毒性や投与中止により地固め療法群の治療期間が短くなったことが、同試験の有効性に関する成績に影響を与えたことは間違いないと、著者らは結論の中で述べている。期間の短かった今回の追跡で効果があることはわかったので、追跡期間が長くなれば免疫療法を用いた地固め療法が後半になって生存期間などに延長効果をもたらす可能性を調べられるだろう。また、どのバイオマーカーのサブグループがこの療法の恩恵を受けられるかを、トランスレーショナルリサーチで調査しているところである。
参考文献:
- Paz-Ares L et al., Durvalumab plus platinum-etoposide versus platinum-etoposide in first-line treatment of extensive-stage small-cell lung cancer (CASPIAN): a randomised, controlled, open-label, phase 3 trial. Lancet 2019; 394: 1929-1939
- Paz-Ares L et al., Durvalumab ± tremelimumab + platinum-etoposide in first-line extensive-stage SCLC: updated results from the phase 3 CASPIAN study. J Clin Oncol 38: 2020 (suppl; abstr 9002)
- Goldman JW et al., Durvalumab ± tremelimumab + platinum-etoposide in 1L ES-SCLC: characterisation of long-term clinical benefit and tumour mutational burden in CASPIAN. ESMO 2020, LBA86
- Horn L et al., First-line atezolizumab plus chemotherapy in extensive-stage small-cell lung cancer. N Engl J Med 2018; 379(23): 2220-2229
- Reck M et al., IMpower133: updated overall survival analysis of first-line atezolizumab + carboplatin + etoposide in extensive-stage SCLC. Ann Oncol 2019; 30(suppl_5): v710-v717
- Liu SV et al., IMpower133: characterization of long-term survivors treated with first line chemotherapy ± atezolizumab in extensive-stage small cell lung cancer ESMO 2020, 1781MO
- Peters S et al., Consolidation nivolumab and ipilimumab vs observation in limited stage SCLC after chemo-radiotherapy – results from the randomized phase II ETOP/IFCT 4-12 STIMULI trial. ESMO 2020, LBA84
© 2020 Springer-Verlag GmbH, Impressum
More posts
治療の選択肢が変わりつつある中でのEGFR TKIの選択肢
治療の選択肢が変わりつつある中でのEGFR TKIの選択肢 アミバンタマブとラゼルチニブの併用療法 EGFRとMETの両遺伝子変異を標的にする二重特異性抗体の
まれな遺伝子変異陽性患者への画期的かつ有効性などが確立した治療薬
まれな遺伝子変異陽性患者への画期的かつ有効性などが確立した治療薬 CROWN試験:ファーストライン療法に用いるALK阻害薬のロルラチニブ 非常に強力で、血液脳
放射線治療と免疫系の相互作用の探索
放射線治療と免疫系の相互作用の探索 Maarten Lambrecht, MD, PhD, Department of Oncology, KU Leuven
小細胞がん患者への治療を成功に導く決め手
小細胞がん患者への治療を成功に導く決め手 CASPIAN試験における予測因子 CASPIAN試験の第Ⅲ相オープンラベルランダム化比較対照試験で進展型小細胞肺が
初期の肺がん:各治療法の注目すべき知見
初期の肺がん:各治療法の注目すべき知見 術後放射線治療に関する第Ⅲ相試験のデータ NSCLCを完全に切除した患者への術後放射線治療(術後照射、PORT)は長年
免疫チェックポイント阻害薬:抗がん剤を使用しない新しい治療レジメンと新規のPD-1阻害薬
免疫チェックポイント阻害薬:抗がん剤を使用しない新しい治療レジメンと新規のPD-1阻害薬 単独療法と化学療法の比較 KEYNOTE-024試験開始から5年後の