治療の選択肢が変わりつつある中でのEGFR TKIの選択肢
アミバンタマブとラゼルチニブの併用療法
EGFRとMETの両遺伝子変異を標的にする二重特異性抗体のアミバンタマブと、強力な作用を持つ第三世代のEGFR TKIラゼルチニブの併用療法について、進行NSCLC患者を対象に調査が進んでいる。 活性化変異と薬剤耐性変異の両方を検出した、複数の型のEGFR遺伝子変異陽性NSCLCにアミバンタマブは臨床活性を示し[1]、プラチナ製剤ベースの化学療法の実施後にエクソン20挿入変異を認めた同NSCLC患者への治療薬として、米食品医薬品局よりブレークスルーセラピー指定を受けた。ラゼルチニブもまた、EGFR遺伝子の活性化変異やT790Mの薬剤耐性変異を検出したNSCLC患者や、CNS転移巣への有効性も示している[2、3]。発疹や下痢といったEGFR-TKI関連毒性の発現率についても他の第三世代の同阻害薬と同様に低くなっている。 両治療薬を併用すると、毒性の発現を増やさずに薬剤耐性の獲得を遅らせたり獲得自体を防いだりできる可能性があると、仮説を立てた。
EGFR遺伝子変異陽性(エクソン19欠失変異、L858R点突然変異)NSCLCの転移巣のある患者や切除不能な患者に、第I相CHRYSALIS試験でアミバンタマブとラゼルチニブの併用療法を行った[4]。その結果、第Ⅱ相試験の推奨用量が各治療薬の単独投与の推奨用量と同等であることが判明した(アミバンタマブの場合、体重が80 kg未満の患者には1,050 mg、80 kg以上の患者には1,400 mg、ラゼルチニブは240 mg)。アミバンタマブの1コース目は1日1回の静脈内投与、2コース目からは隔週1回の静脈内投与とし、ラゼルチニブは1日1回の経口投与とした。用量漸増コホートは26人、用量拡大コホートは65人で構成し、用量拡大コホートの45人はオシメルチニブの耐性がある化学療法を受けていない患者で、残る20人は未治療患者だった。合計91人の患者のうちベースライン時に脳転移を認めたのは37%、これまでに受けた治療ラインの数は0から9、第一世代または第二世代のEGFR TKIの治療を受けたことのある患者は59%、第三世代の同阻害薬の治療を受けたことのある患者は58%だった。
奏効に達するのが早く持続期間も長い
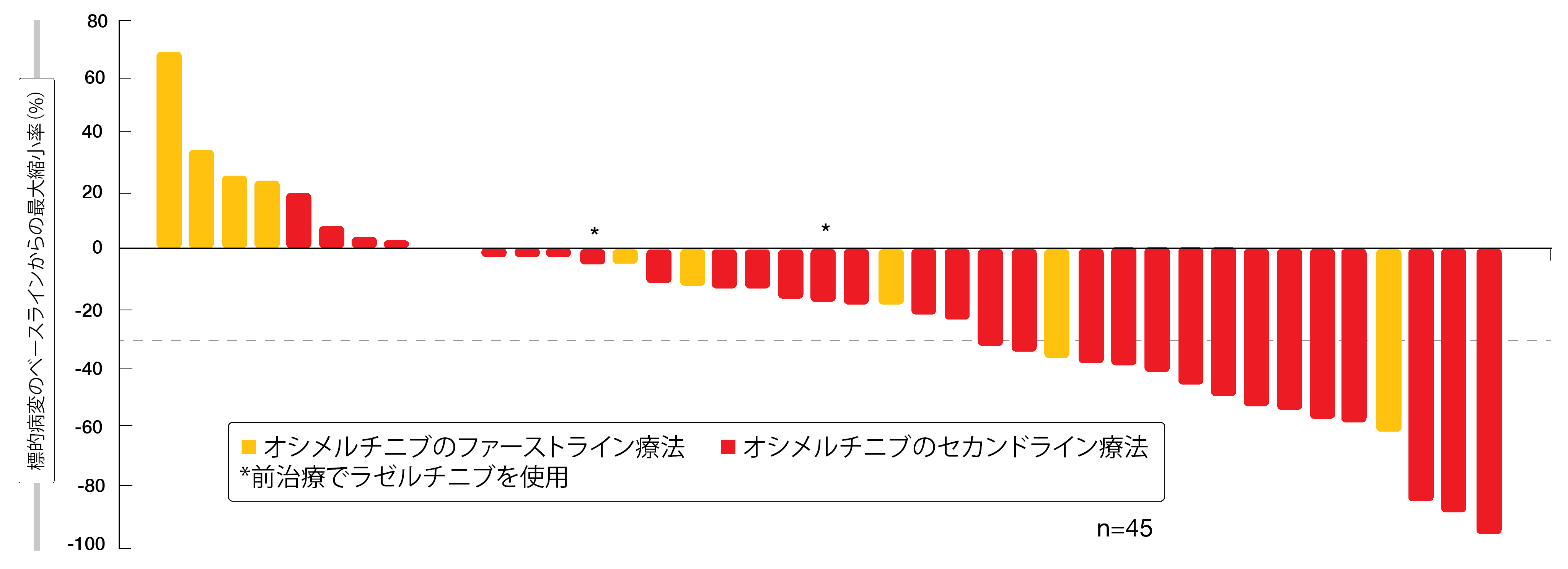
オシメルチニブの耐性がある化学療法未実施の患者群のうち36%のORRが判明し、1人が完全奏効に、15人が部分奏効の判定を受けた。臨床的有用率は60%となった。オシメルチニブをどの治療ラインで使用したかに関わらず腫瘍退縮がみられ、以前にラゼルチニブの治療を受けた際に病勢が進行した患者にもこれがみられた(図1)。大半の患者で奏効状態が続いており、この患者群のバイオマーカーとCNS転移に関する解析結果を、今後の総会で発表することになるだろう。未治療患者群のORRと臨床的有用率はそれぞれ100%で、EGFR遺伝子の変異型を問わず腫瘍縮小効果を認めた。1回目の奏効に達するまでの期間は中央値で1.5か月と短かった。中央値にして7か月間の追跡後でも全患者が治療を続けていた。
アミバンタマブとラゼルチニブの併用療法は安全性が高く忍容性も良好で、用量漸増期に用量制限毒性が生じることはなかった。発現した有害事象は主にグレード1か2で、重篤な治療関連有害事象の発現率は6%、グレード3以上の発現率は11%だった。最も発現率の高かった有害事象は予想したとおり発疹で85%に及び、次いで注入に伴う反応(65%)となった。注入に伴う反応がみられたのは初回投与時がほとんどで、投与中止や用量調節が必要になることはなかった。有害事象の発現によって、アミバンタマブとラゼルチニブのどちらか一方あるいは両方を休薬もしくは減量したのはそれぞれ19%だったが、投与中止が必要になったのはわずか6%だった。用量漸増群、未治療患者群、オシメルチニブの耐性がある化学療法未実施群のいずれでも有害事象の発現率はほぼ同じだった。
アミバンタマブはラゼルチニブと安全に併用することが可能で、この併用療法がEGFR遺伝子変異陽性進行NSCLC患者に臨床活性を示したと著者らは結論づけた。耐性メカニズムごとの有効性に関する解析が現在行われている。アミバンタマブとラゼルチニブの併用療法を評価する新しい臨床試験が始まっており、その中でも第Ⅲ相MARIPOSA試験(NCT04487080)ではファーストラインでのこの併用療法の使用をオシメルチニブと比較している。
図1:オシメルチニブ耐性がある化学療法未実施患者へのアミバンタマブ+ラゼルチニブ併用療法後の標的病変の変化率
併用療法のパートナーになる血管新生阻害薬:アパチニブ
血管内皮細胞増殖因子受容体(VEGFR)シグナル伝達経路を遮断すると、EGFR TKI療法の有効性が高まることが示されている[5]。そこで、ACTIVE試験の第Ⅲ相多施設共同二重盲検プラセボ対照ランダム化比較試験で、EGFR TKIのゲフィチニブと経口低分子化合物のVEGFR2チロシンキナーゼ阻害薬のアパチニブをファーストラインの併用療法として進行肺がん患者に投与して評価することになった[6]。局所進行性や転移性、再発性のEGFR遺伝子変異陽性非扁平上皮NSCLCで化学療法を受けたことのない患者を、中国の30施設で1日1回のアパチニブ500 mgとゲフィチニブ250 mgの併用療法群(n=157)またはプラセボとゲフィチニブの対照群(n=156)のどちらかにランダムに割り付けた。
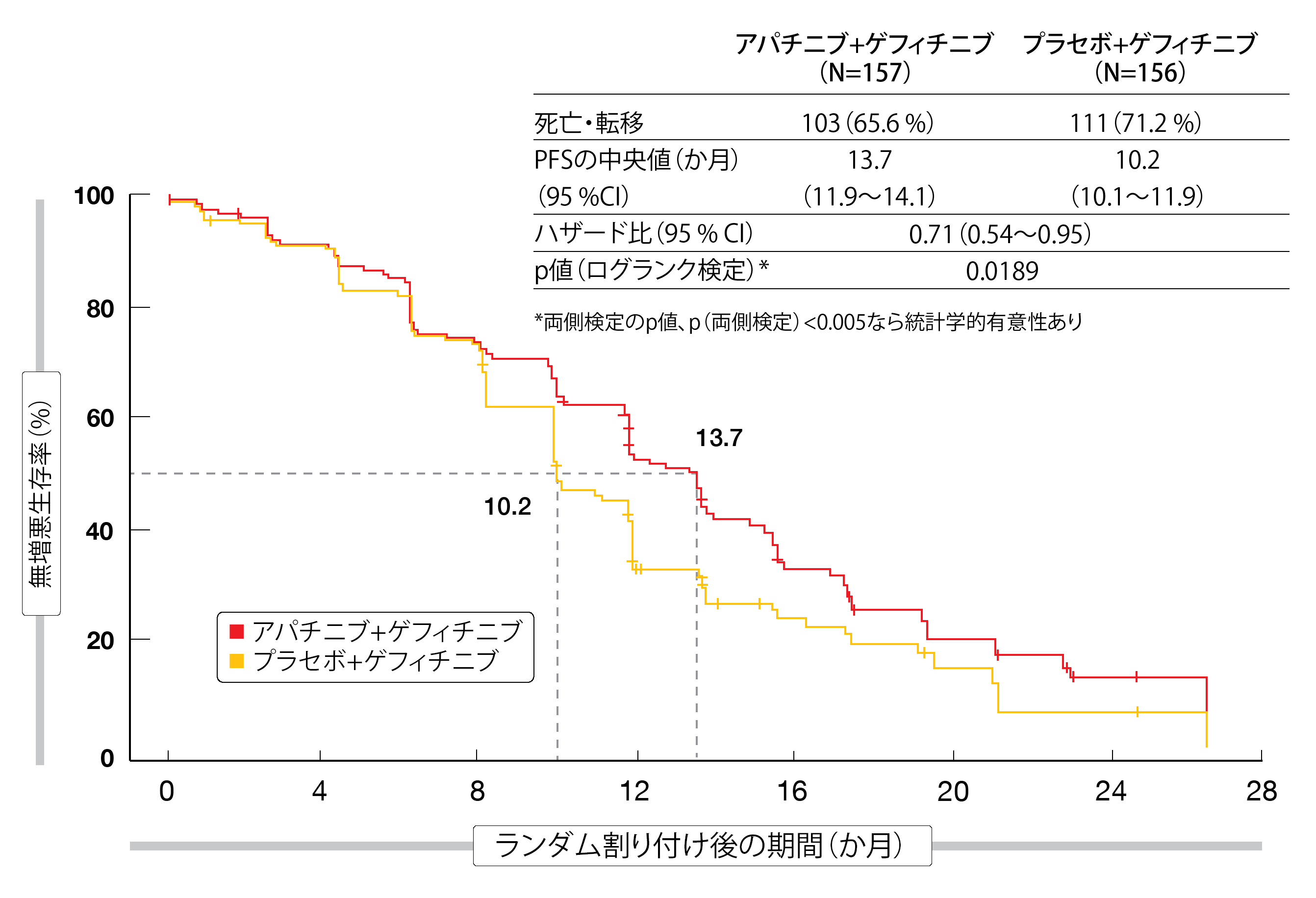
独立評価委員会のX線画像所見に基づいたPFSを主要評価項目としたが、併用療法群に良好な結果がみられた(併用療法群は13.7か月、対照群は10.2か月、HR:0.71、p=0.0189、図2)。ほぼすべてのサブグループにアパチニブを併用した効果が認められた。ORR(併用療法群は77.1%、対照群は73.7%)もDCR(前者は84.7%、後者は87.8%)も対照群と大差なかったが、30%以上(前者は89.2%、後者は79.5%、p=0.0209)と50%以上(前者は64.3%、52.6%、p=0.0238)の腫瘍縮小効果については併用療法群に統計学的有意な改善が認められた。奏効期間についても併用療法群で長くなった(前者は12.9か月、後者は9.3か月、HR:0.64、p=0.005)。併用療法の忍容性はおおむね高く、毒性も治療可能な内容だった。治療関連有害事象(TEAE)が原因で休薬が必要になったのは併用療法群で59.9%、対照群で22.7%となり、減量が必要になったのは前者が48.4%、後者が4.5%となったが、併用療法群でTEAEによる投与中止が必要になったのはわずか5.1%である(対照群は3.2%)。アパチニブとゲフィチニブそれぞれの安全性プロファイルに当てはまらない、予期せぬ有害事象は生じなかった。
患者145人に行ったバイオマーカー解析(併用群は73人、対照群は72人)によると、TP53遺伝子のエクソン8変異を検出した患者(HR:0.24)には、同エクソン8変異のない患者(HR:0.79)を上回る併用療法の効果が認められた。TP53遺伝子変異のない患者ではPFSに延長効果がまったくみられなかったが(HR:0.92)、対象患者数の少なさが原因なので、大規模試験でこの点を確認する必要がある。EGFR遺伝子のエクソン19欠失変異を検出した患者とエクソン21のL858R点突然変異を検出した患者には、PFSの延長効果が認められている(HRは前者が0.67、後者が0.72)。耐性獲得に関するバイオマーカー解析によると、両群にT790M耐性変異によく似たパターンが現れており、この変異の陽性率は併用療法群で37.8%、対照群で37%だった。著者らは報告の中で、アパチニブとゲフィチニブの併用療法はEGFR遺伝子変異陽性進行NSCLC患者にとって、新たなファーストライン療法の選択肢になる可能性があると語った。この併用療法はどちらも経口薬なので、長期投与が必要な患者にとって負担の少ない治療法になるだろう。
図2:プラセボ+ゲフィチニブと比較したアパチニブ+ゲフィチニブによる無増悪生存期間の延長効果
オシメルチニブとベバシズマブの併用療法にベネフィットなし
T790M変異陽性NSCLC患者への標準治療である第三世代のEGFRチロシンキナーゼ阻害薬のオシメルチニブと、抗VEGF抗体のベバシズマブとの併用療法の成績は振るわなかった。第Ⅱ相WJOG8715Lランダム化比較試験では、EGFRチロシンキナーゼ阻害薬耐性を示すT790M耐性陽性の進行肺がん患者を対象に、オシメルチニブ80 mgの1日1回投与とベバシズマブ15 mg/kgの3週間隔投与の併用(n=40)を、オシメルチニブ80 mgの1日1回の単独投与(n=40)を比較した。
本総会であった一次解析結果の報告によると、併用療法群に主要評価項目のPFSに延長効果がみられなかった(併用療法群は9.4か月、単独療法群は13.5か月、HR:1.44、p=0.20)[7]。このことはサブグループ解析の結果でも確認した。以前に抗VEGF療法を受けた患者の場合、併用療法群のPFSが他の療法群(オシメルチニブ+ベバシズマブ[事前の抗VEGF療法なし]併用群、オシメルチニブ単独[事前の抗VEGF療法実施の有無は問わず])よりもさらに短くなった。ORRは併用療法群が単独療法群の数値を上回ったが(前者は71.8%、後者は55.0%)、治療成功期間とOSのどちらにも両群間に統計学的有意差は認められなかった。蛋白尿や高血圧といった有害事象の発現率も併用療法群で統計学的有意に高くなっていた。
抗体薬物複合体のパトリツマブデルクステカン
HER3はEGFR遺伝子変異陽性肺がんのおよそ80%に発現し、この過剰発現が臨床的アウトカムの悪さにつながっている[8]。被験薬の抗HER3抗体薬物複合体パトリツマブデルクステカン(U3-1402)について、転移性または切除不能な EGFR遺伝子変異陽性NSCLC患者を対象に第I相試験で評価した。用量漸増コホートは、オシメルチニブの投与中に病勢が進行した患者や、エルロチニブ、ゲフィチニブ、アファチニブのいずれかの投与中に病勢が進行した後のT790M変異が陰性だった患者12人で構成した。用量拡大コホートは、EGFR TKIを1剤以上使用し、プラチナ製剤ベースの化学療法を1コース以上受けた患者で構成した(n=45)。この両コホートに、第Ⅱ相試験のパトリツマブデルクステカンの推奨用量5.6 mg/kgの3週間隔投与を行った。
両コホートに関する最新の知見をYuらが報告した[9]。このコホートは治療ライン数の中央値が4という、かなり多くの治療を受けている患者で構成している。86%の患者が試験の組み入れ前にオシメルチニブ療法を受けており、プラチナ製剤ベースの化学療法を受けていたのは90%、PD-(L)1阻害薬の投与を受けていたのは40%だった。無症状で脳転移巣が安定していれば組み入れることにしたので、CNS転移を認める患者が47%になった。後ろ向き解析に使用するので治療開始前に腫瘍組織を採取していたが、HER3の発現状態を患者選択の基準にはしなかった。同解析結果から大半の患者にHER3の発現が認められた。
46人の奏効状態を評価した。中央値にして5か月間追跡した時点で確認したORRは25%で、確定していない3例の部分奏効は除外している (表)。1人(2%)が完全奏効に達し、病勢コントロール率は70%になった。奏効に達した患者が早い段階からみられ、大半の患者にある程度の腫瘍の縮小がみられた。血漿や腫瘍組織の検体を用いた次世代シークエンシングによれば、さまざまな耐性変異のある患者に臨床的意義のある抗腫瘍作用がみられ、EGFR C797S変異、MET遺伝子増幅、 HER2遺伝子増幅、 BRAF融合遺伝子、PIK3CA遺伝子の変異が陽性の部分奏効の判定を受けた患者もこの中に含まれている。なお、PFSの中央値を出せる時期には達していなかった。
パトリツマブデルクステカン5.6 mg/kg投与に関わる安全性プロファイルは、引き続き治療可能な内容だった。発現率が最高になったグレード3以上のTEAEは血小板減少症と好中球減少症の両方だったが、このどちらかが原因で投与中止になる患者はいなかった。3例の間質性肺炎(5.3%)が報告されたが、ほとんどのTEAEは減量や休薬で対処できた。上述のデータを総合してみると、分子標的薬の選択肢がない患者へのパトリツマブデルクステカンの使用について、さらに臨床研究が必要になることがわかった。EGFR TKIやプラチナ製剤ベースの化学療法の効果が認められなかった患者を対象にした、パトリツマブデルクステカン単独療法の有効性などを調べる第Ⅱ相試験が、2021年の早い時期に始まる予定である。
低用量アファチニブの評価
EGFR遺伝子変異陽性NSCLC患者にとってアファチニブは有効な治療薬ではあるが、その毒性のなかでもとりわけ爪や皮膚の有害事象のほか下痢が原因で用量調節が必要になることがしばしばある。治療開始時から用量を少なくすれば有効性を損ねず安全性を改善できる可能性があるという仮説に基づいて、発現頻度の多いEGFR遺伝子変異陽性で未治療の進行NSCLC患者を対象に、野呂らが第Ⅱ相多施設共同単群オープンラベル試験でアファチニブ20 mgの1日1回投与を評価した[10]。完全奏効、部分奏効、安定のいずれかに達し、8週間目に腫瘍の増大がなかった患者には20 mg投与を続け、腫瘍が増大した患者には1日の用量を30 mgまたは40 mgまで増量した。増量後にグレード2以上の薬剤関連有害事象が現れた場合は10 mgずつ減量した。治療開始後9日目と病勢進行のあった時点で血漿中アファチニブ濃度を測定した。日本国内の21施設に53人の患者が参加した。
66.0%の患者(n=35)が部分奏効に達した。このうち30人(56.6%)に20 mgの連日投与が続いたが、残る5人(9.4%)は同じ用量でも投与間隔が隔日に減った。安定の判定を受けた患者(n=14、26.4%)のうち、用量を30 mgに増量したのは4人(7.5%)、40 mgに増量したのは2人(3.8%)、20mg投与を続けられたのは8人だった。 病勢進行を認めたのは3人(5.7%)で、評価不能だったのは1人だった。アファチニブ20 mg投与の病勢コントロール率は全体で92.5%にのぼった。PFSの中央値は12.6か月、治療成功期間の中央値は9.7か月となったが、OSの中央値は解析の時点で判明していなかった。
グレード3以上の有害事象が12人(22.6 %)に生じ、そのうち下痢が生じたのは4人(7.5 %)だった。これは、第Ⅲ相試験でアファチニブ40 mgを投与したときに起きたグレード3以上の有害事象と下痢の発現率(前者は49%、後者は14.4%)よりも低い数値になっている[11]。治療開始後9日目の血漿中アファチニブ濃度はORRと治療成功期間のどちらとも相関しておらず、パフォーマンスステータス、喫煙歴、病期、下痢を含めた有害事象とも相関性はなかった。唯一、統計学的有意性のある相関性がみられたのはEGFR遺伝子の変異型で、L858R点突然変異群よりもエクソン19欠失変異群で血漿中濃度が高くなっていた(p=0.03)。血漿中濃度が低い場合でも(平均値11.4 ng/ml)臨床活性を示すことがわかった。以上の知見を踏まえると、アファチニブ20 mg投与はEGFR遺伝子変異陽性NSCLC患者への標準治療になりうると、著者らは強調した。
ヨーロッパでのEGFR TKI使用
後ろ向きの多国間REFLECT試験では、第一世代と第二世代のEGFRチロシンキナーゼ阻害薬をファーストライン療法に用いた場合の治療と検査のパターンのほか臨床的アウトカムそして投与中止率を、オーストリア、ブルガリア、ギリシャ、イスラエル、ポーランド、ルーマニア、スロベニア、スイスで調査した[12]。2015年1月1日から2018年6月30日までにアファチニブ、ゲフィチニブ、エルロチニブのいずれかの投与を始めた、 EGFR遺伝子変異陽性の局所進行NSCLC患者と転移性NSCLC患者の合計896人を解析対象にした。ヨーロッパで行われた同試験は、第一世代や第二世代のEGFR TKIのファーストライン療法の中止率を調べる大規模試験のひとつである。
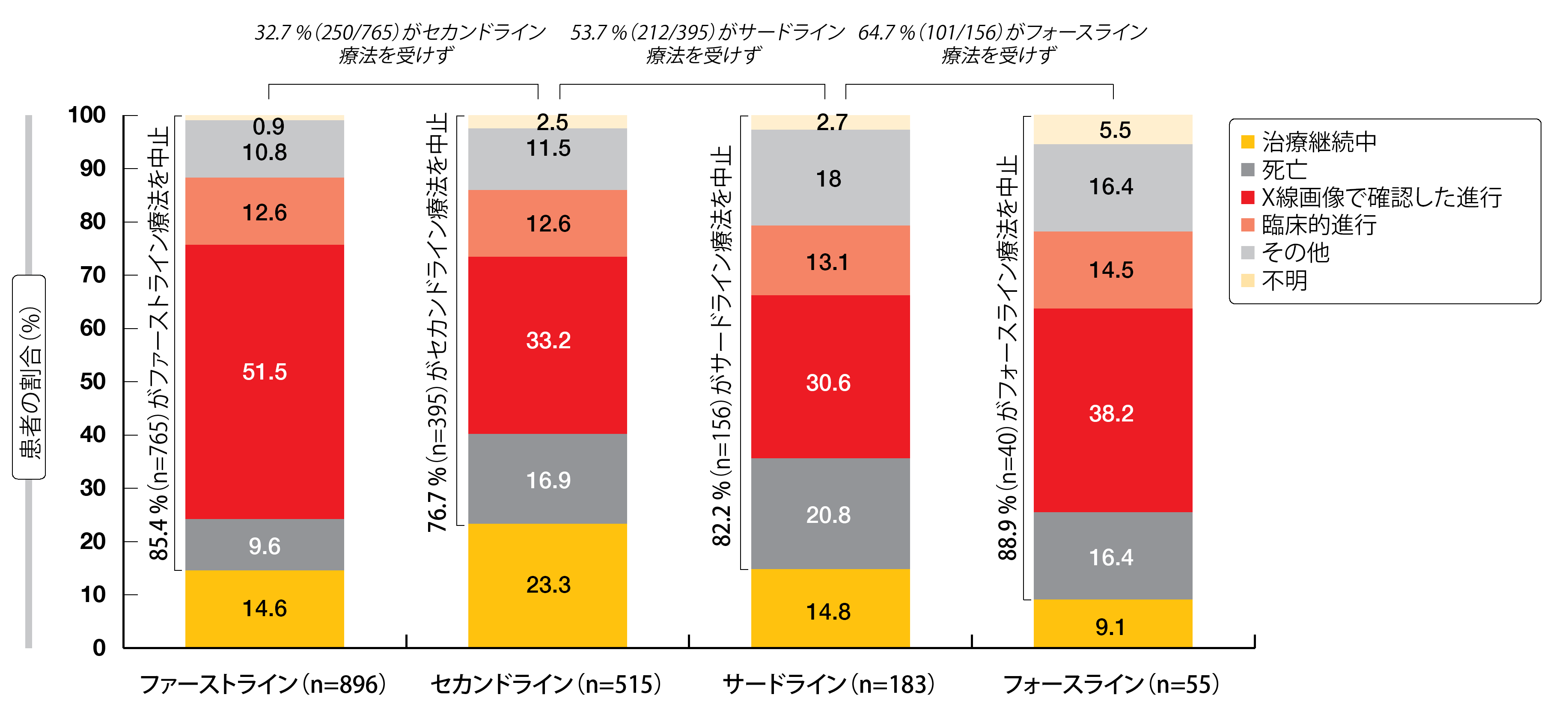
アファチニブ、エルロチニブ、ゲフィチニブを投与した割合はそれぞれ45.4%、27.3%、27.2%だった。データ収集日の時点で85.4%の患者が投与中止になっており、ファーストライン療法の場合、投与中止までの期間の中央値は12.6か月になった。いずれの治療ラインでもX線画像で確認した病勢進行が投与中止の主な理由になっており、次の治療ラインを受けない患者の割合も治療ラインが進むごとに増加していった(図3)。EGFR TKIのファーストライン療法実施中に病勢進行した患者(n=723)のうち、T790M耐性変異の有無を調べるため検査を受けたのは513人(71.0%)に限られた。このうち陽性結果が出た患者の割合は58.3%である。T790M耐性変異陽性を確認した患者の94.6%にセカンドライン以降でオシメルチニブを投与しており、大半がセカンドラインで投与していた。T790M耐性変異陰性患者の場合はこれが41人(18.5%)になり、この耐性変異を確認する検査を受けていない患者では15人(6.2%)になった。
ファーストライン療法開始からのPFSの中央値は13.0か月、同OSの中央値は26.2か月だった。著者らが報告で述べたように、第一世代や第二世代のEGFR TKIのファーストライン療法にEGFR遺伝子変異陽性NSCLC患者の生存期間などを延長させる効果が不足していることが、この試験で示された。臨床的アウトカムを改善させるためには、EGFR TKIの効率的な使用法を深く知ることが第一である。ただ、第三世代のEGFR TKIのオシメルチニブがファーストライン療法として承認を受けると、治療薬の選択肢が変わるだろう。今後、実臨床で多くのエビデンスが積み上がることが待たれる。
図3:REFLECT試験での投与中止率と治療ライン別の中止理由
参考文献:
- Haura EB et al., JNJ-61186372 (JNJ-372), an EGFR-cMet bispecific antibody, in EGFR-driven advanced non-small cell lung cancer (NSCLC). J Clin Oncol 37, 2019 (suppl; abstr 9009)
- Ahn MJ et al., Lazertinib in patients with EGFR mutation-positive advanced non-small-cell lung cancer: results from the dose escalation and dose expansion parts of a first-in-human, open-label, multicentre, phase 1-2 study. Lancet Oncol 2020; 20(21): 1681-1690
- Kim SW et al., Intracranial anti-tumor activity of lazertinib in patients with advanced NSCLC who progressed after prior EGFR TKI therapy: Data from a phase I/II study. J Clin Oncol 38: 2020 (suppl; abstr 9571)
- Cho BC et al., Amivantamab (JNJ-61186372), an EGFR-MET bispecific antibody, in combination with lazertinib, a third-generation EGFR tyrosine kinase inhibitor, in advanced EGFR-mutant NSCLC. ESMO 2020, 1258O
- Larsen AK et al., Targeting EGFR and VEGF(R) pathway cross-talk in tumor survival and angiogenesis. Pharmacol Ther 2011; 131(1): 80-90
- Zhang L et al., ACTIVE: apatinib plus gefitinib versus placebo plus gefitinib as first-line treatment for advanced epidermal growth factor receptor-mutant non-small-cell lung cancer: a multicenter, randomized, double-blind, placebo-controlled phase III trial (CTONG1706). ESMO 2020, LBA50
- Toi Y et al., A randomized phase II study of osimertinib with or without bevacizumab in advanced lung adenocarcinoma patients with EGFR T790M mutation. ESMO 2020, 1259O
- Tan CS et al., Third generation EGFR TKIs: current data and future directions. Mol Cancer 2018; 17(1): 29
- Yu HA et al., Efficacy and safety of patritumab deruxtecan (U3-1402), a novel HER2 directed antibody drug conjugate, in patients with EGFR-mutated NSCLC. ESMO 2020, LBA62
- Noro R et al., A prospective, phase II trial of low-dose afatinib monotherapy for patients with EGFR mutation-positive non-small cell lung cancer (TORG1632). ESMO 2020, 1365P
- Kato T et al., Afatinib versus cisplatin plus pemetrexed in Japanese patients with advanced non-small cell lung cancer harboring activating EGFR mutations: Subgroup analysis of LUX-Lung 3. Cancer Sci 2015; 106(9): 1202-1211
- Addeo A et al., Real-world treatment patterns, clinical outcomes and EGFR/T790M testing practices in patients with EGFR-mutated advanced NSCLC and 1L EGFR TKI therapy – a retrospective multinational study (REFLECT). ESMO 2020, 1299P
© 2020 Springer-Verlag GmbH, Impressum