胃癌和食管癌中PD-1抑制取得的里程碑式进展
胃癌、胃食管连接部(GEJ)腺癌和食道腺癌是全球范围内与癌症相关死亡的重要原因,并且在晚期被诊断出时其5年总生存率(OS)较差[1, 2]。对于晚期或转移性HER2阴性胃癌和GEJ癌,标准一线化疗的中位OS不到1年[3-6]。
一些针对胃癌和GEJ癌的抗PD-(L)1单一疗法的临床研究得到了阴性结果。然而,在2017年的随机化、双盲、安慰剂对照的III期ATTRACTION-2试验中显示,在至少两条先前治疗线之后,纳武单抗改善胃癌和GEJ癌患者的生存率[7]。非随机化II期KEYNOTE-059研究证明了在相同条件下派姆单抗的活性[8]。在KEYNOTE-180 [9,10]和KEYNOTE-181 [11]试验中,派姆单抗单一疗法在患有晚期/转移性食道腺癌或食道鳞状细胞癌的预治疗患者中也被证明是有益的。基于这些研究,美国食品和药物管理局(FDA)在2019年批准将派姆单抗用于经≥1个治疗线后的合并阳性评分(CPS)≥ 10的复发性、局部晚期或转移性食管鳞状细胞癌[12]。在ESMO 2020上介绍了大型III期研究,该研究评估纳武单抗或派姆单抗联合一线化疗对晚期胃癌、GEJ癌和食道癌的益处。
ATTRACTION-4的III期部分
随机化、多中心、II/III期ATTRACTION-4研究评估了纳武单抗加化疗作为HER2阴性的晚期胃癌或胃食管连接部癌患者的一线治疗。在试验的II期部分显示出令人鼓舞的结果[13]后,Boku等人在2020 ESMO大会上报告了ATTRACTION-4的双盲、随机化、对照的III期部分的主要发现[14]。在日本、韩国和台湾的130个中心,在纳武单抗每3周360 mg(Q3W)或安慰剂的情况下,患者接受S-1加奥沙利铂(oxaliplatin)或卡培他滨(capecitabine)加奥沙利铂直至进展。每个组包含362名患者。无进展生存期(PFS)和OS被定义为主要终点。
对于PFS,与安慰剂加化疗相比,基于纳武单抗的疗法被证明更加优越,中位数为10.45与8.34个月(HR,0.68;p = 0.0007)。在1年时,分别有45.4%与30.6%的患者存活且无进展。所有亚组均受益于免疫检查点抑制剂的添加;该受益与PD-L1表达无关(≥ 1%与< 1%)。但是,根据最终分析,OS并没有显著改善。中位OS为17.45与17.15个月(HR,0.90;p = 0.257)。
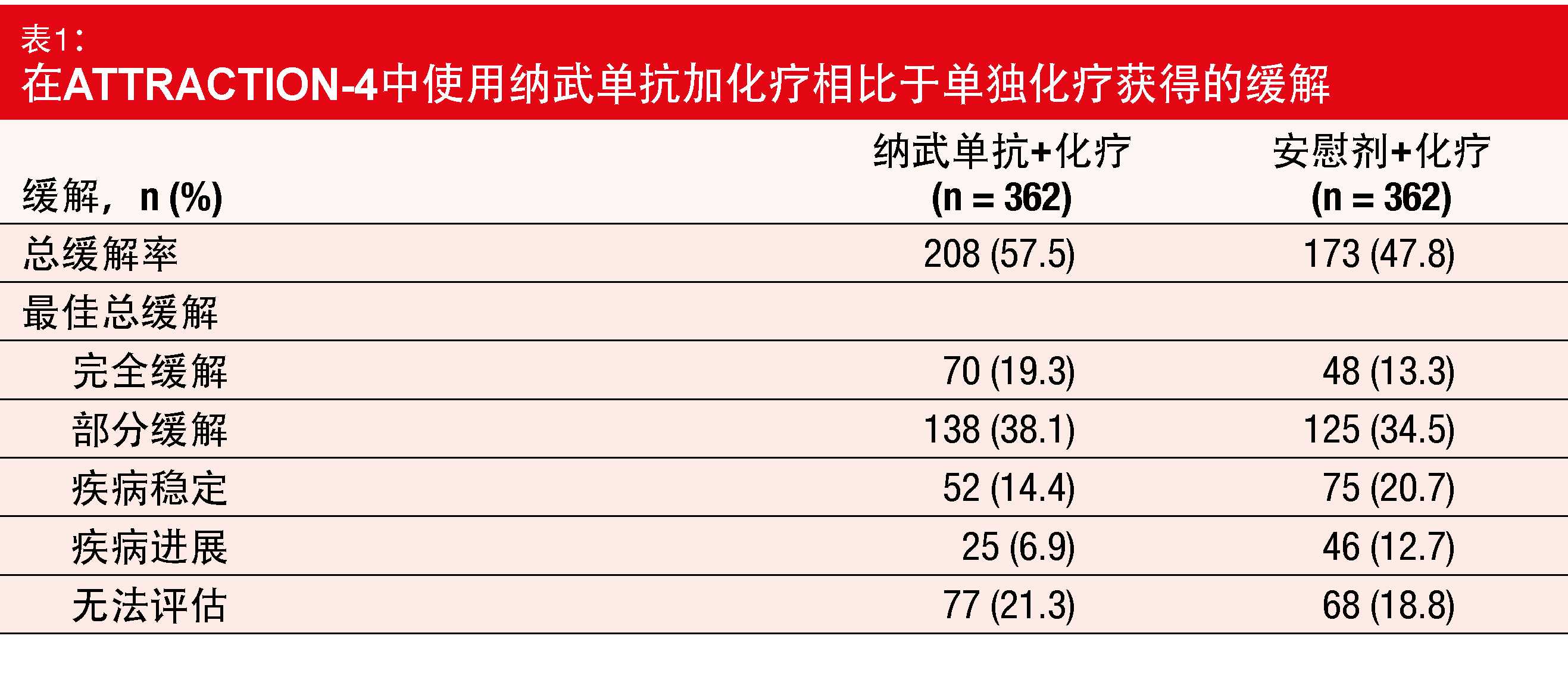
在实验组中接受治疗的患者中有更大比例(57.5%比47.8%;p = 0.0088;表1)对于治疗发生缓解。与单独的化疗相比,纳武单抗加化疗的缓解持续时间更长(12.91与8.67个月)。该组合显示出可控的安全特性。在两个组中,导致终止或剂量延迟/减少的AE的频率相当。
正如作者在总结中所指出,根据方案,如果满足了至少一项主要终点,则该试验被视为阳性,因此ATTRACTION-4的III期部分的目标已经实现,证明有临床意义的疗效。对于不能切除的晚期或复发性胃癌或GEJ癌患者,纳武单抗加化疗可被视为新的一线治疗选择。
CheckMate 649:基于近1600名患者的见解
CheckMate 649是针对晚期胃癌、GEJ癌和食道腺癌患者的,在一线条件下考察基于PD-1抑制剂的疗法的最大的随机化全球III期研究。Möhler等人在ESMO 2020上报告了化学免疫疗法与化疗之间比较的第一个结果[15]。大约790名患有无法切除的晚期或转移性HER2阴性肿瘤的患者被随机分到各个组。化学免疫疗法由纳武单抗360 mg加XELOX Q3W或者纳武单抗240 mg加FOLFOX Q2W组成,而对照组中的患者仅接受XELOX Q3W或FOLFOX Q2W。
基于观察到在胃癌、GEJ癌和食道癌中,CPS截止值≥5时的PD-L1表达显示出比肿瘤细胞PD-L1表达能更好地富集检查点抑制剂的功效[16],分层次地进行了OS测试。统计计划规定,如果PD-L1 CPS ≥ 5人群中的OS被证明明显更优,则对PD-L1 CPS ≥ 1组中的OS进行测试,然后对所有随机化的患者进行OS测试。PD-L1 CPS ≥ 5的人群分别包括实验组和对照组中的473名和482名患者。对于PD-L1 CPS ≥ 1组,分别为641名和655名。此次没有介绍CheckMate 649研究的第三组的结果,该第三组评估了先用纳武单抗加易普利姆玛,后用纳武单抗单一疗法进行的双重检查点抑制。
不同组中的改善
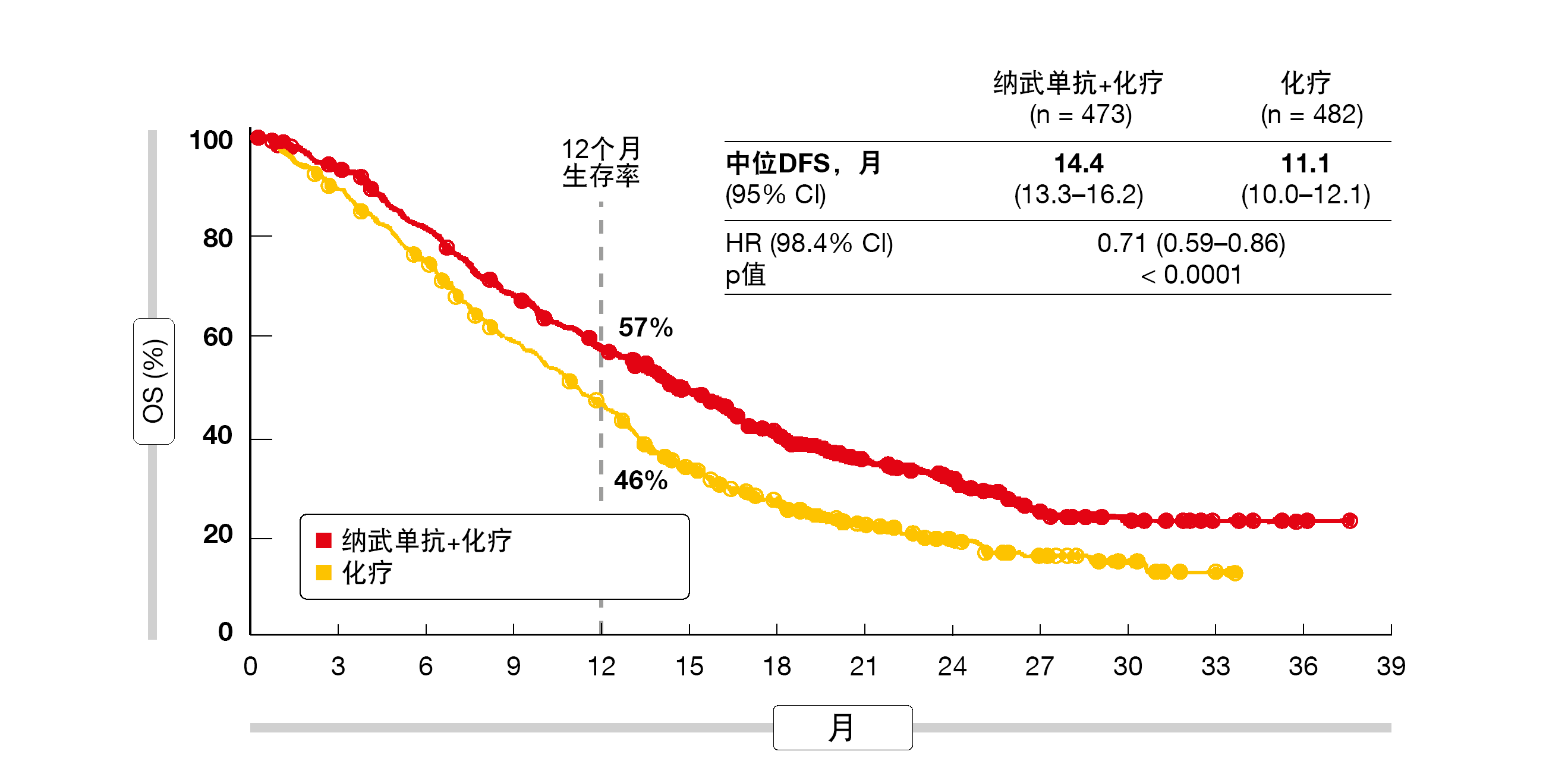
CPS ≥ 5人群的总体生存率和PFS被定义为双重主要终点。在该组(14.4与11.1个月;HR,0.71;p < 0.0001;图1)以及CPS ≥ 1的人群(14.0与11.3个月;HR,0.77;p = 0.0001)和所有随机分组的患者(13.8与11.6个月;HR,0.80;p = 0.0002)中,添加纳武单抗确实带来了统计学上显著且临床相关的OS优势。在多个亚组中,OS结果始终支持使用纳武单抗加化疗。同样,接受纳武单抗加化疗的CPS ≥ 5患者的PFS明显更长(7.7与6.0个月;HR,0.68;p < 0.0001)。对于CPS ≥ 1组(7.5与6.9个月;HR,0.74)和总随机化群体(7.7与6.9个月;HR,0.77),也观察到实验方案在PFS方面的优效性。经纳武单抗治疗的患者的缓解比例明显更高(60%与 45%;p < 0.0001),而且更持久(9.5与7.0个月)。
没有新的安全性信号出现,并且该组合的安全特性与各个药剂的特性一致。两组中最常见的任何级别的治疗有关AE(TRAE)包括恶心、腹泻和周围神经病变。在CPS ≥ 5以及两组中治疗的所有患者中,TRAE的发生率相似;这也适用于选择潜在免疫病因的TRAE。在这里,在≤ 5%的患者中观察到3/4级事件。作者在其结论中强调,在此前未经治疗的晚期胃癌、GEJ癌和食道癌患者中,纳武单抗是首个在联合化疗时表现出与单独化疗相比更优越的OS和PFS的PD-1抑制剂。因此,这种组合代表了这种条件下新的潜在一线标准。
图1: CheckMate 649的主要终点:在CPS≥5人群中,使用纳武单抗加化疗与化疗的总生存率获益
KEYNOTE-590:派姆单抗的益处
在食管癌患者中,随机化、双盲、安慰剂对照的III期KEYNOTE-590研究评估了200 mg Q3W派姆单抗(最大35个周期)加5-FU和顺铂(cisplatin)(n = 373)与安慰剂加化疗(n = 376)作为一线治疗的比较[17]。纳入人群患有局部晚期、不可切除或转移性食管腺癌、鳞状细胞癌或晚期/转移性食管胃连接部(EGJ)Siewert 1型腺癌。两组中,食管鳞状细胞癌(ESCC)约占73%。在患有腺癌的患者中,已诊断出食道或EGJ疾病的比例大致相等。两组中大约一半的研究参与者显示出PD-L1 CPS ≥ 10。
一线派姆单抗加化疗确实在多个终点方面提供了统计学上显著且具有临床意义的益处。总队列的中位OS分别为12.4与9.8个月(HR,0.73;p < 0.0001),风险降低了27%。PD-L1 CPS≥10的患者的死亡风险降低了38%(13.5与9.4个月;HR,0.62;p < 0.0001)。对于ESCC群组,OS为12.6与9.8个月(HR,0.72;p = 0.0006),而对于患有ESCC且PD-L1 CPS ≥ 10的群组,OS为13.9与8.8个月(HR,0.57;p < 0.0001)。24个月的OS率表明在实验组中具有持续的益处(表2)。关于PFS,在总人群(6.3与5.8个月;HR,0.65;p < 0.0001)、ESCC队列(6.3与5.8个月;HR,0.65;p < 0.0001)和PD-L1 CPS ≥ 10组(7.5与5.5个月;HR,0.51;p < 0.0001)中观察到改善。所有亚组在OS和PFS方面都受益于派姆单抗的添加。在整个队列中,接受派姆单抗治疗的患者中有45.0%的患者缓解,而对照组中有29.3%的患者缓解(p < 0.0001)。中位缓解持续时间为8.3与6.0个月。
报道的两个治疗组的安全特性相当。≥ 3级TRAE的比例为71.9%与67.6%,必须终止治疗的比例为19.5%与11.6%。免疫介导的AE和输注反应的比例分别为25.7%与11.6%,其中多数事件分级为轻度或中度。作者得出结论认为,对于包括EGJ腺癌在内的局部晚期和转移性食管癌患者,派姆单抗加化疗应成为新的一线治疗标准。
使用辅助纳武单抗的DFS翻倍
在可切除的局部晚期食管癌和GEJ癌条件下,先新辅助放化疗后手术(即三联疗法)是一种广泛使用的护理标准[18-20]。然而,三联疗法后复发的风险仍然很高,特别是在残余病理性疾病患者中,并且缺乏既定的辅助治疗[18-21]。
在CheckMate 577试验中研究了纳武单抗的辅助使用,该试验是评估三联疗法之后使用检查点抑制剂治疗食道癌/GEJ癌的首个全球性、随机化、双盲III期研究[22]。总计794名患有II/III期疾病且具有腺癌或鳞状细胞组织学的患者被随机分配为先纳武单抗 240 mg Q2W 16周,后纳武单抗480 mg Q4W(n = 532)或安慰剂(n = 262)。这些患者在随机分组之前的4至16周内接受了新辅助放化疗和手术,并且残余病理疾病≥ ypT1或≥ ypN1。总治疗时间长达1年。
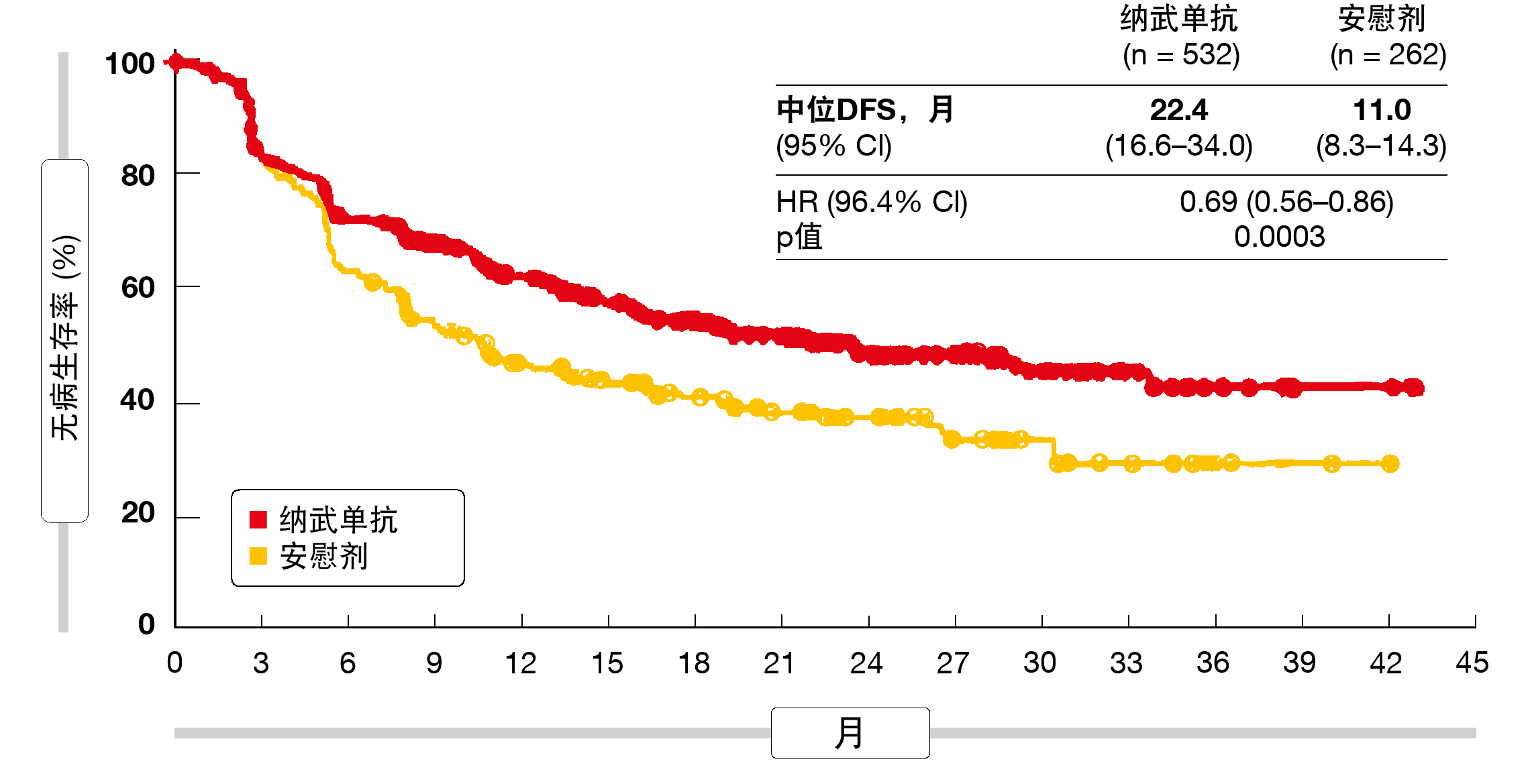
无疾病生存期构成主要结果。辅助纳武单抗在此具有显著益处,使复发或死亡的风险降低了31%(22.4与11.0个月;HR,0.69;p = 0.0003;图2)。在所有预先定义的亚组中的发现均支持该PD-1抑制剂优于安慰剂。纳武单抗具有良好的耐受性,并显示出可接受的安全特性。大多数TRAE为1级或2级,只有9%促使终止治疗。据报告,疲劳、腹泻、瘙痒和皮疹是最常见的TRAE。在纳武单抗组中,不到1%的患者发生3/4级TRAE。相应地,根据EQ-5D-3L量表,患者报告的结果分析显示,纳武单抗和安慰剂的总体健康状态相似。正如作者所指出,这些结果代表了多年来在经切除的食道癌和GEJ癌患者中的首次进步,并有可能将辅助纳武单抗确定为新的治疗标准。
图2: 在CheckMate 577试验中使用辅助纳武单抗观察到的无病生存率
视觉估算的CPS与常规CPS
尽管已批准的PD-1抑制剂在胃食管腺癌患者中显示出令人鼓舞的生存期改善,但许多患者没有应答,这突出了预测性生物标志物的需求。可以使用CPS和Dako 22C3测定法评估PD-L1表达,不过这种评分方法的使用在临床实践中可能很困难。因此,已经开发出了一种基于对肿瘤和免疫细胞上的PD-L1表达进行视觉估计的耗时较少的算法,其被称为视觉估算的CPS(vCPS),用于VENTANA PD-L1(SP263)测定法。Chao等人基于首次人体BGB-A317-001研究的样本的事后分析比较了CPS(采用Dako 22C3)和vCPS(采用VENTANA PD-L1 SP263)的临床利用,BGB-A317-001研究研究测试了PD-1抑制剂替雷利珠单抗(tislelizumab)在胃食管腺癌患者中的效果[23]。在该组81名个体中,分别通过CPS和vCPS评估了49名和74名患者的福尔马林固定、石蜡包埋的肿瘤的PD-L1表达。四十五名患者可以使用这两种测定法评估。
根据统计分析、患病率和病理可行性,将vCPS ≥ 5%的截止值确定为最佳截止值。使用肿瘤样品对此进行了进一步开发和分析验证。在评估的截止值处,vCPS ≥ 5%的VENTANA PD-L1(SP263)测定法和CPS ≥ 1的商业化Dako 22C3测定法均有助于鉴定高PD-L1表达的患者,这些患者比那些患有低PD-L1肿瘤的患者更可能受益于治疗。通过不同病理学家、材料和实验室使用vCPS进行VENTANA PD-L1(SP263)测定法的可重复性表明,该测定法具有高度可训练性,并且在胃癌和GEJ腺癌中具有一致性。
对vCPS ≥ 5%的进一步临床验证正在一项III期研究中进行,该研究旨在比较替雷利珠单抗加铂/氟嘧啶与安慰剂加铂/氟嘧啶作为胃癌和GEJ癌的一线治疗的效果(RATIONALE 305;BGB-A317-305)。
参考文献
- Ajani JA et al., Gastric adenocarcinoma. Nat Rev Dis Primers 2017; 3: 17036
- Rubenstein JH, Shaheen NJ. Epidemiology, diagnosis, and management of esophageal adenocarcinoma. Gastroenterology 2015; 149(2): 302-317
- Lordick F et al., Capecitabine and cisplatin with or without cetuximab for patients with previously untreated advanced gastric cancer (EXPAND): a randomised, open-label phase 3 trial. Lancet Oncol 2013; 14 (6): 490-499
- Catenacci DVT et al., Rilotumumab plus epirubicin, cisplatin, and capecitabine as first-line therapy in advanced MET-positive gastric or gastro-oesophageal junction cancer (RILOMET-1): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2017; 18(11): 1467-1482
- Shah MA et al., Effect of fluorouracil, leucovorin, and oxaliplatin with or without onartuzumab in HER2-negative, MET-positive gastroesophageal adenocarcinoma: the METGastric randomized clinical trial. JAMA Oncol 2017; 3(5): 620-627
- Fuchs CS et al., Ramucirumab with cisplatin and fluoropyrimidine as first-line therapy in patients with metastatic gastric or junctional adenocarcinoma (RAINFALL): a double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Oncol 2019; 20(3): 420-435
- Kang YK et al., Nivolumab in patients with advanced gastric or gastro-oesophageal junction cancer refractory to, or intolerant of, at least two previous chemotherapy regimens (ONO-4538-12, ATTRACTION-2): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2017; 390(10111): 2461-2471
- Fuchs CS et al., Safety and efficacy of pembrolizumab monotherapy in patients with previously treated advanced gastric and gastroesophageal junction cancer: phase 2 clinical KEYNOTE-059 Trial. JAMA Oncol 2018; 4(5): e180013
- Shah et al., Efficacy and safety of pembrolizumab for heavily pretreated patients with advanced, metastatic adenocarcinoma or squamous cell carcinoma of the esophagus: the phase 2 KEYNOTE-180 study. JAMA Oncol 2019; 5(4): 546-550
- Kato et al., Pembrolizumab in previously treated metastatic esophageal cancer: longer term follow-up from the phase 2 KEYNOTE-180 Study. J Clin Oncol 37, 2019 (suppl; abstr 4032)
- Shah et al., Pembrolizumab versus chemotherapy as second-line therapy for advanced esophageal cancer: Phase 3 KEYNOTE-181 study. J Clin Oncol 37, 2019 (suppl; abstr 4010)
- https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-pembrolizumab-advanced-esophageal-squamous-cell-cancer#:~:text=On%20July%2030%2C%202019%2C%20the,FDA%2Dapproved%20test%2C%20with%20disease
- Boku N et al., Safety and efficacy of nivolumab in combination with S-1/capecitabine plus oxaliplatin in patients with previously untreated, unresectable, advanced, or recurrent gastric/gastroesophageal junction cancer: interim results of a randomized, phase II trial (ATTRACTION-4). Ann Oncol 2019; 30(2): 250-258
- Boku N et al., Nivolumab plus chemotherapy versus chemotherapy alone in patients with previously untreated advanced or recurrent gastric/gastroesophageal junction cancer: ATTRACTION-4 (ONO-4538-37) study. ESMO 2020, LBA7_PR
- Möhler M et al., Nivolumab plus chemotherapy versus chemotherapy as first-line treatment for advanced gastric cancer/gastroesophageal junction cancer/esophageal adenocarcinoma: first results of the CheckMate 649 study. ESMO 2020, LBA6_PR
- Lei M et al., American Association for Cancer Research Annual Meeting 2019, abstract 2673
- Kato K et al., Pembrolizumab plus chemotherapy versus chemotherapy as first-line therapy in patients with advanced esophageal cancer: the phase 3 KEYNOTE-590 Study. ESMO 2020, LBA8_PR
- NCCN Esophageal Cancer Guidelines V1.2020
- Lordick F et al., Oesophageal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2016; 27(suppl 5): v50-v57
- Shah MA et al., Treatment of locally advanced esophageal carcinoma: ASCO Guideline. J Clin Oncol 2020 28(23): 2677-2694
- Blum Murphy M et al., Pathological complete response in patients with esophageal cancer after the trimodality approach: The association with baseline variables and survival-The University of Texas MD Anderson Cancer Center experience. Cancer 2017; 123(21): 4106-4113
- Kelly RJ et al., Adjuvant nivolumab in resected esophageal or gastroesophageal junction cancer following neoadjuvant chemoradiation therapy: first results of the CheckMate 577 study. ESMO 2020, LBA9
- Chao Y et al., Investigation of PD-L1 expression and tislelizumab efficacy in gastroesophageal adenocarcinoma using a novel tumor and immune cell score with VENTANA PD-L1 (SP263) assay and combined positive score (CPS). ESMO 2020, 154P
© 2020 Springer-Verlag GmbH, Impressum
More posts
卵巢癌:将PARP抑制更进一步
卵巢癌:将PARP抑制更进一步 尼拉帕利(niraparib)的个性化用量 根据NOVA试验的结果,尼拉帕利已被批准作为铂敏感性复发性卵巢癌(OC)患者的维持
将创新从实验室带入临床实践
将创新从实验室带入临床实践 Andrés Cervantes, MD, PhD, 西班牙大学临床医院医学肿瘤学系, 生物医学研究所INCLIVA, 瓦伦西亚大
胃癌和食管癌中PD-1抑制取得的里程碑式进展
胃癌和食管癌中PD-1抑制取得的里程碑式进展 胃癌、胃食管连接部(GEJ)腺癌和食道腺癌是全球范围内与癌症相关死亡的重要原因,并且在晚期被诊断出时其5年总生存
序言
序言 Ronan Kelly, MD, MBA 美国德克萨斯州达拉斯 贝勒大学医学中心Charles A. Sammons癌症中心主任 亲爱的同事们, 2020年线上ES