免疫療法:兆しが見えた新規バイオマーカーとピボタル床試験からのニュース
腫瘍変異負荷はSCLCに関係するか?
再発小細胞肺癌(SCLC)の患者については、使用できる治療選択肢が限られている。CheckMate 032試験では、1回以上のプラチナベースの化学療法レジメンによる治療を事前に受けたSCLC患者のPD-L1非選別コホートで抗CTLA-4抗体イピリムマブとの併用または併用なしで抗PD-1抗体ニボルマブを評価した。ニボルマブ単剤と併用の両方がこの条件で次のような優れた活性を示した:2年OS率はそれぞれ26 %と14 %であった[1]。PD-L1状況に関わらず、奏効を示した。
SCLCではPD-L1発現が稀であるため、この腫瘍タイプでの免疫療法には改良されたバイオマーカーが必要である。一次治療としてのニボルマブを化学療法と比較した無作為化第III相CheckMate 026試験において、ニボルマブの使用に関する予測バイオマーカーとして腫瘍変異負荷(TMB)を特定し た[2]。そのため、この所見がSCLCに当てはまるかを評価する目的でAntoniaらはCheckMate 032試験データの予備TMB分析を行った[3]。
TMB評価可能群には、ニボルマブ単剤による治療を受けた患者とニボルマブとイピリムマブの併用治療を受けた患者、それぞれ133例と78例の合計211例を含めた。TMBは全エキソームシーケンシングによって判定され、腫瘍中のミスセンス変異の総数として計算された。分析のために、TMB三分位数に基づいて患者を3つのサブグループに分けた。TMB評価可能な患者は、両方の治療群でPFSとOSについて同等の転帰を示す全集団の代表であった。
高いTMBによって改善した活性
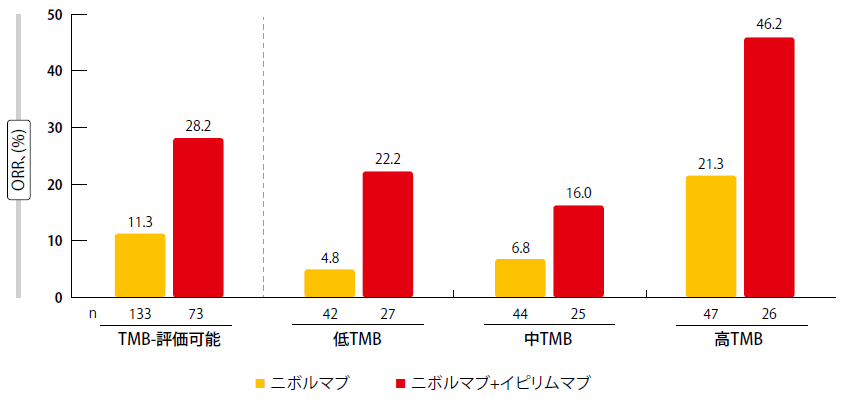
TMBサブグループ別のORR分析によれば、ニボルマブ治療に対して、TMBが低、中、高の群全体にわたって4.8%~21.3%の漸進的なORR上昇が観察された(図1)。一方で、ニボルマブとイピリムマブの併用では、低TMB群と中TMB群で同様の奏効率を生じ、高TMB群では46.2%の優れたORRを示した。
同じように、両治療において無増悪生存期間がかなり長かった高TMB群ではPFSに関しても異なる有益性が見られた。1年時に、高TMB群のPFSはニボルマブ単剤療法と併用療法でそれぞれに21.2%、30.0%であった。これとは対照的に、低および中TMB群のPFSは1桁の範囲であった。OS分析によって、ニボルマブ単剤療法はTMB上昇という漸進的な生存率効果が明らかになった。1年OSは低、中、高TMBの患者についてそれぞれ、22.1%、26.0%、
35.2%であった。対照的に、ニボルマブとイピリムマブの併用投与を受けた患者では、1年OSが低または中TMB群
(それぞれ23.4%、19.6%)と比較してTMBが高い場合にかなり良好であった(、62.4%)。
全般的に、NSCLCの場合、、腫瘍変異負荷に応じてSCLC患者は免疫治療薬治療に対して異なる反応を示すことが明らかになった。高TMBの患者では、ニボルマブ単剤療法と、ニボルマブとイピリムマブの併用の両方に対して転帰が改善したが、所見は併用群のほうが明らかに安定していた。TMBカットオフの最適化とTMBのプロスペクティブ試験が必要である。著者が結論付けたように、TMBはすべての肺癌にわたって関連性のある予測バイオマーカーであるかもしれない。
図1:CheckMate 032: 腫瘍変異負荷と奏効率との関係
OAK:Teff遺伝子発現に従った分析
既存免疫のマーカーであるエフェクターT細胞(Teff)遺伝子署名ーの高度発現は、抗PD-1抗体アテゾリズマブによる治療を受けた患者の生存期間改善と相関することが第II相POPLAR試験で示されている[4]。そのため、第III相OAK試験のレトロスペクティブ予備分析は、Teff遺伝子発現とこの試験で見られたアテゾリズマブの臨床的有益性の間の関連性を評価するために行われた[5]。OAK試験に含まれた患者は2次治療以降にアテゾリズマブまたはドセタキセルの治療を受けた。ドセタキセルと比較してアテゾリズマブはOS中央値を有意に改善しが(13.8ヶ月対9.6ヶ月;HR、0.73;p=0.0003)、アテゾリズマブのPFSに対する有益性はPD-L1発現が高度の患者のみで観察されたことが主要解析によって示された[6]。
OAK 試験の主な集団では、Teff 遺伝子発現の評価に十分な腫瘍組織が患者 753例で見られた。この解析では、Teff 遺伝子署名は 3 つの遺伝子(PDL1、CXCL9、IFNG)のmRNA発現によって定義された。免疫組織化学(IHC)検査に基づくとTeff遺伝子署名とPD-L1発現の間には部分的な重複があったが、同時に、Teff遺伝子署名によってPD-L1陰性集団内の特有の患者サブセットを特定した。
PFS予測の精度向上
Teff遺伝子署名はPD-L1発現よりもPFSのバイオマーカーとして感度が高いことを試験の結果は意味している。3段階のTeff遺伝子発現レベルについて評価を行った。高い発現レベルとアテゾリズマブが媒介するPFSに対する有益性との間に有意な関連性があることが分析によって示された。Teff遺伝子発現の多い(50%以上)患者ではPFS HRは0.73であったが、発現の少ない(50%未満)患者では1.30であった。
IHC検査に従うPDL-1集団発現率とTeff遺伝子集団発現率が同等である状況で、PDL-1発現状況に比べTeff遺伝子署名によりアテゾリズマブ療法によってPFSが大幅に延長した患者がより多く特定された。(表)。OSについては、アテゾリマブが媒介する有益性はバイオマーカー評価可能集団全体で認められたものと同等であったが、Teff遺伝子署名はすべての発現カットオフ値において結果の改善をより明確に示した。
これらの所見は、既存の免疫が肺癌患者における免疫治療薬の有効性を決定する重要な生物学的側面である可能性があることを示唆している。進行中の試験は、一次NSCLC治療における免疫療法有効性の潜在的な予測バイオマーカーとしてのTeff遺伝子署名の役割をさらにバリデートするようにデザインされている。
PACIFIC試験: 機能とQOL
二重盲検、プラセボ対照国際第III相PACIFIC臨床試験では、根治的なプラチナベースの化学放射線同時併用療法後に進行が見られなかったステージIII、局所進行、切除不能NSCLCの患者を対象として、抗PD-L1抗体デュルバルマブを2週間毎に10mg/kg、最長12ヶ月投与する群(n=476)をプラセボ群(n=237)と比較した。PD-L1発現状況に基づく患者の選択は行わなかった。中間PFS解析では、プラセボと比較してデュルバルマブで有意に優れた所見が得られた(PFS中央値、16.8ヶ月対5.6ヶ月;HR、0.52;p<0.0001) [7]。
WCLCにおいてHuiらは患者報告転帰(PRO)を発表したが、これはPACIFIC試験で事前に規定された副次的評価項目であった[8]。EORTC QLQ-C30 v3質問票とその肺癌モジュールQLQ-LC13を用いて、症状、身体機能、および全体的な健康状態/QOLを評価した。この評価によれば、、重要な症状のスコアのほか、機能と全体的な健康状態は、デュルバルマブとプラセボの両方で試験期間を通して安定していた。ベースラインからの変化に関しては、治療群間に有意な差はなかった。嚥下障害と脱毛症について48週目に臨床的に意義のあるベースラインからの改善が各群で認められたことから、すべての患者が受けた化学放射線同時併用療法に関連して生じていた毒性が解消したことが示唆される。「食欲喪失」項目の改善のオッズはデュルバルマブで大きかったが、機能または他の症状の改善率については群間差は認められなかった。機能や症状の悪化までの時間について、大部分の項目に関してデュルバルマブとプラセボの間に差がないことが分析で示された。「その他の痛み」の悪化までの時間のみがデュルバルマブで長かった(HR、0.72)。しかし、この差は他の「痛み」項目には反映されなかった。
全体的に、化学放射線療法後に12ヶ月間デュルバルマブを追加することで、局所進行して切除不能なNSCLC患者のQOLは低下しなかったことがこの分析で示された。PACIFIC試験からの肯定的な有効性と安全性に関するデータと共に、これらの所見は早期条件でのデュルバルマブの臨床的価値をさらに支持するものである。
1次治療ペムブロリズマブ: KEYNOTE-024の最新情報
Brahmerらは、PD-L1を発現している(腫瘍比率スコア[TPS]が 50 %以上)未治療のステージIVのNSCLC患者305例でペムブロリズマブとプラチナベース化学療法を比較する国際的無作為化非盲検第III相KEYNOTE-024臨床試験の新たな分析結果を発表した[9]。主要解析によって、PFS(HR、0.50)とOS(HR、0.60)に関して化学療法を上回るペムブロリズマブの有意な優位性が明らかになったが、ペムブロリズマブ治療群のOS中央値にはその時点では到達していなかった[10]。
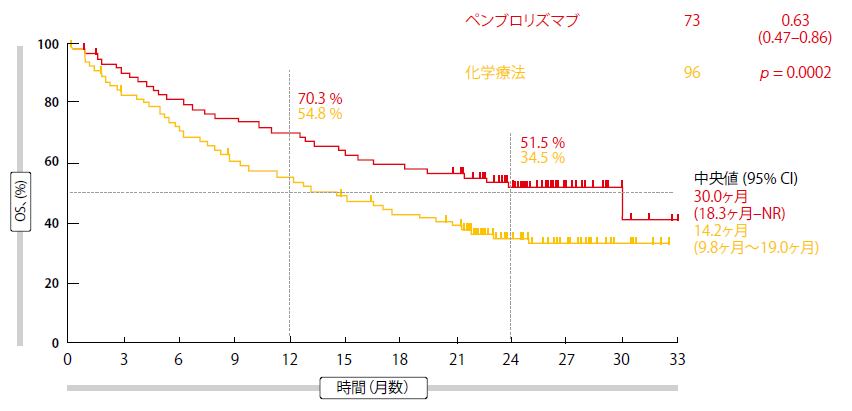
中央値25.2ヵ月のフォローアップの後、OSに関する新たな分析を行った結果、ペムブロリズマブに有意な有益性があることが示され、生存率の中央値は30.0ヵ月という注目に値する結果であった(化学療法群では14.2ヵ月、HR, 0.63; p = 0.002;図2)24ヶ月時OS率は、ペムブロリズマブと化学療法による治療を受けた患者でそれぞそれ、51.5%、34.5%であった。化学療法群では抗PD-1療法への有効乗換え率が63%と大きかったにもかかわらず、この改善は維持された。
ORRは、ペムブロリズマブ群と化学療法群においてそれぞれ45.5%、
29.8%であった(p=0.0031)。ペムブロリズマブに乗り換えた患者のORRは20.7%であった。ペムブロリズマブ治療群の全患者で、奏効期間中央値にまだ到達していなかった(対して、化学療法治療群では7.1ヶ月)。化学療法治療群の2倍以上である7.9ヶ月の曝露中央値の後、ペムブロリズマブは好ましい安全性プロファイルを示し続けた。ペムブロリズマブは、PD-L1発現が高い(TPSが50%以上)NSCLC患者の1次治療の標準治療として今後も使用される著者は結論付けた。
図2:更新されたKEYNOTE-024臨床試験における全生存期間転帰
脳転移患者におけるニボルマブ
イタリアの拡大アクセスプログラムは、比較臨床試験外のステージIIIB/IVの非扁平上皮NSCLCおよびCNS転移患者を対象として、最長24ヶ月間、2週間ごとにニボルマブ3mg/kg投与を評価する機会となった[11]。登録前の少なくとも2週間は神経症状がなく、かつ全身的コルチコステロイド治療を必要としない、あるいは10mg/日以下のプレドニゾンまたはプレドニゾン同等品の投与で安定しているか用量を減量している脳病変のある患者を適格とした。153施設で参加した1,588例の患者の全集団のうち、409例(26%)は無症候性で制御された脳転移を有した。29%はベースライン時にステロイド治療を受けており、18%は放射併用線療法を受けていた。
この群でのニボルマブ治療の有効性と安全性はコホート全体とCheckMate 057臨床試験集団で観察されたものと同等であるように見えた。ORRとDCRはそれぞれ17%、40%であった。CRが患者4例(1%)で生じ、PRが患者64例(16%)で、SDが患者96例(23%)で生じた。OS中央値は、全患者における11.3ヶ月と比較して、CNS転移患者については8.6ヶ月であった。1年時に、CNS転移患者と全コホートのそれぞれ43%と48%が生存していた。CNSコホートと全集団の療法が3.0ヶ月のPFS中央値を示した。PFSが1年の比率は20%と22%であった。CNS転移患者はニボルマブによる免疫療法から恩恵を受けられることをこれらの結果が示唆した。
参考文献
- Hellmann MD et al., Nivolumab (nivo) ± ipilimumab (ipi) in advanced small-cell lung cancer (SCLC): First report of a randomized expansion cohort from CheckMate 032.J Clin Oncol 35, 2017 (suppl; abstr 8503)
- Carbone DP et al., First-line nivolumab in stage IV or recurrent non-small-cell lung cancer.N Engl J Med 2017; 376: 2415-2426
- Antonia SJ et al., Impact of tumor mutation burden on the efficacy of nivolumab or nivolumab + ipilimumab in small cell lung cancer: an exploratory analysis of Checkmate 032.WCLC 2017, OA 07.03a
- Fehrenbacher L et al., Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicentre, open-label, phase 2 randomised controlled trial.Lancet 2016; 387(10030): 1837-1846
- Kowanetz M et al., Pre-existing immunity measured by Teff gene expression in tumor tissue is associated with atezolizumab efficacy in NSCLC.WCLC 2017, MA 05.09
- Rittmeyer A et al., Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK): a phase 3, open-label, multicentre randomised controlled trial.Lancet 2017; 389(10066): 255-265
- Antonia SJ et al., Durvalumab after chemoradiotherapy in stage III non-small-cell lung cancer.N Engl J Med 2017 Sep 8. doi: 10.1056/NEJMoa1709937.[Epub ahead of print]
- Hui R et al., Patient-reported outcomes with durvalumab after chemoradiation in locally advanced, unresectable NSCLC: data from PACIFIC.WCLC 2017, PL 02.02
- Brahmer JR et al., Updated analysis of KEYNOTE-024: pembrolizumab versus platinum-based chemotherapy for advanced NSCLC with PD-L1 TPS ≥ 50%.WCLC 2017, OA 17.06
- Reck M et al., Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer.N Engl J Med 2016; 375: 1823-1833
- Crinò L et al., Italian nivolumab expanded access programme (EAP): data from patients with advanced non-squamous NSCLC and brain metastasis.WCLC 2017, P1.01-053
- Borghaei H et al., Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer.N Engl J Med 2015; 373: 1627-1639
More posts
化学療法:新しいアプローチ、新しいセッティング
化学療法:新しいアプローチ、新しいセッティング SCAT: BRCA1を用いた補助化学療法のカスタマイズ 最新ガイドラインでは、完全切除したリンパ節転移(ステージII~II
悪性中皮腫:ニンテダニブとチェックポイント阻害薬に関する最新データ
悪性中皮腫:ニンテダニブとチェックポイント阻害薬に関する最新データ 悪性胸膜中皮腫(MPM)は、未治療のままだと生存期間中央値が7~9ヵ月となる浸潤性腫瘍である[1]。切除
標的治療による扁平上皮細胞癌のアプローチ
標的治療による扁平上皮細胞癌のアプローチ アファチニブで予想される有益性 EGFR変異状況は、扁平上皮癌(SCC)組織構造を持つNSCLC患者においては日常的な検査の対象で
免疫療法:兆しが見えた新規バイオマーカーとピボタル床試験からのニュース
免疫療法:兆しが見えた新規バイオマーカーとピボタル床試験からのニュース 腫瘍変異負荷はSCLCに関係するか? 再発小細胞肺癌(SCLC)の患者については、使用できる治療選択
抗EGFR薬治療のさらなる使用:1次治療以降の治療
抗EGFR薬治療のさらなる使用:1次治療以降の治療 事前のEGFR TKI治療後のオシメルチニブ 一般に獲得抵抗性は一次EGFR TKI療法の続に生じ、その最も一般的な機序
「肺癌のより良い管理に向けて着実に進歩しています」
「肺癌のより良い管理に向けて着実に進歩しています」 Keunchil Park, MD, PhD 韓国ソウル、成均館大学校、サムスン医療センター、革新的癌医学研究所、血液/