抗EGFR薬治療のさらなる使用:1次治療以降の治療
事前のEGFR TKI治療後のオシメルチニブ
一般に獲得抵抗性は一次EGFR TKI療法の続に生じ、その最も一般的な機序はゲートキーパーT790M変異である。第3世代の不可逆性EGFR TKIであるオシメルチニブが、この変異を保有する腫瘍がある患者の治療に認可されている。シンガポールでの早期アクセスプログラムに参加した患者52例における一次治療以降の治療で用いる治療薬オシメルチニブの活性が、Tanらによるレトロスペクティブデータで示された[1]。2次治療から9次治療までの(中央値、3次治療)事前のEGFR TKI治療中の進行後、オシメルチニブが投与された。患者の53%には、治療開始時に脳転移があった。
独立して評価したORRは46%であ、奏効期間中央値は8.7ヶ月であった。完全奏効(CR)率と部分奏効(PR)率はそれぞれ7.7%、38.5%であった。疾患安定は40.4%で生じた。PFS中央値は10.3ヶ月であった。OSデータは分析時に十分ではなかった。オシメルチニブは2次治療を超える有効性を示すほか、CNS転移の存在にかかわら有効であった。
CNS制御に関するデータ
オシメルチニブはCNSに作用することが知られており、このことはWCLCで提示された分析によって確認された。Zhuらは、症候性の脳病巣のある患者10例を対象として第1世代TKI治療後のオシメルチニブ80mgの有効性を評価した[2]。患者2例はCNSでPRとなり、、7例は疾患安定(SD)となった。同様に、2次オシメルチニブ治療では、非盲検多国間実環境ASTRIS治療試験に参加した測定可能なベースライン時脳転移のある韓国人患者で、有意なCNS制御をもたらした[3]。奏効に関して評価可能な患者16例の集団において、患者全員がPRを達成すると共に頭蓋内ORRが81.3%であった。頭蓋内奏効期間の中央値にはまだ到達していなかった。オシメルチニブは、放射線治療歴に関係なく臨床的なCNS有効性を示した。
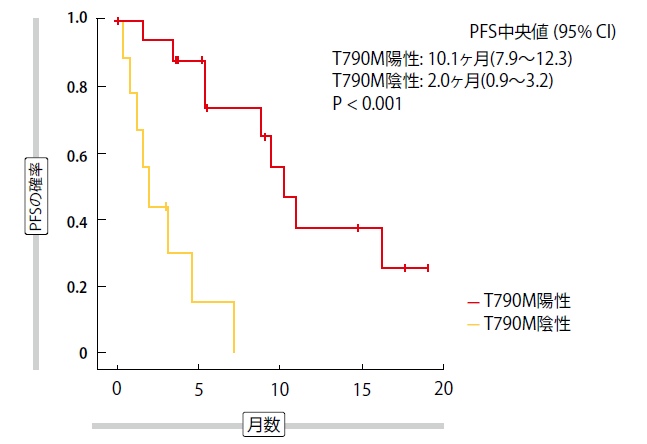
単一群第II相TREM臨床試験では、1回以上のEGFR TKI治療後に進行したT790M陽性とT790M陰性の患者でのオシメルチニブの活性を評価した[4]。脳転移のある患者34例が含まれた。オシメルチニブにはCNS病変がある患者においてCNS病変がない患者と同様の有効性が見られたが、T790M陰性患者での有益性はかなり低いことを示唆する結果が示された。全体的に、患者の75%で疾患制御が生じたが、この割合はT790M陰性群よりもT790M陽性群でかなり高かった(88%対38%)。PFSはこれら2群で10.1ヶ月対2.0ヶ月であった(p<0,001;図1)。一方で、脳転移のある患者と脳転移のない患者の間にPFSの有意な差はなかった(7.2ヶ月対9.7ヶ月;p=0.300)。
図1:脳転移患者におけるオシメルチニブ:T790M変異状況別のる無増悪生存期間
アファチニブ後のT790M変異の発現率
エルロチニブとゲフィチニブによる1次治療に対する抵抗性が生じた患者では、T790M変異の発現率は49%~69%であった[5~7]。しかし、アファチニブに対する抵抗性機序に関するデータは特に白人患者で不足している。T790M変異の発現もアファチニブ抵抗性の主な機序であることが既存のエビデンスから示唆されており、発現率は48~68%である[7、8]。
Hochmairらは、その単一施設レトロスペクティブ分析で、アファチニブ治療中に進行した患者におけるEGFR T790M変異の発現率のほか、この群でのオシメルチニブに対する反応を評価した[9]。オシメルチニブは、AURA3試験において第1世代または第2世代EGFR TKI治療の不成功後の2次治療として良い結果を示したが、この試験に含まれた患者の7%のみが1次アファチニブ治療を受けた[10]。同時に、アファチニブの後にオシメルチニブという順序で処方される患者で臨床転帰が良好であることを新たに得られたデータが示唆している。LUX-Lung 3、6および7臨床試験のレトロスペクティブ分析によると、アファチニブ不成功後のオシメルチニブ治療期間の中央値は20.2ヶ月であり、OS中央値にはまだ到達していなかった[11]。
一貫した変異率および優れた奏効
アファチニブによって3ヶ月以上の制御を最初に達成した後に進行した患者48例がこの分析に含まれた。患者の75%において、1次条件でアファチニブが使用されており、患者の19%と6%がそれぞれ2次治療薬または3次治療薬としてTKIの治療を受けた。56%(n=27)でEGFR T790M変異が発現したことが検査で示された。これは、以前の分析[7、8]から入手可能な発現率、およびエルロチニブまたはゲフィチニブ治療中に進行した患者でのT790M変異率[5–7]と一致している。
液体生検所見を確認するために患者34例で追加の組織再生検を実施し、2件の試験間で91%の一致率を示した。T790M変異の出現は、ベースライン特性またはアファチニブに対する奏効期間などの他のパラメーターとは相関しないと思われた。2次または3次治療でアファチニブの投与を受けている患者の場合、、アファチニブ治療の不成功後に初めて検査を行うためT790M変異がいつ出現したかは分からない。
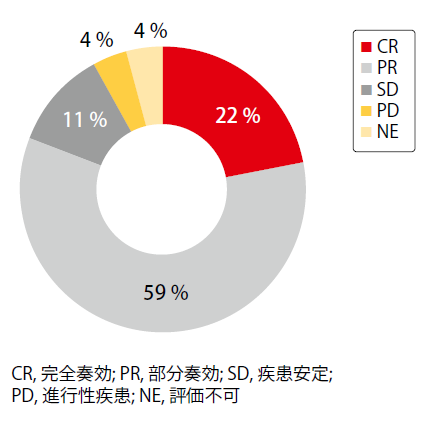
T790M変異が生じた患者27例において、オシメルチニブによる治療は81%という高いORRを生じさせ、患者の22%はCRに達した(図2)。オシメルチニブに対する奏効期間に関するデータは分析時に十分ではなかった。オシメルチニブ治療は患者11例(41%)で継続中であった。アファチニブとオシメルチニブによる逐次治療期間の中央値は25.0ヶ月であった。
図2:アファチニブによって3ヶ月以上の疾患制御を最初に達成した後にT790M変異を生じた患者におけるオシメルチニブへの反応
オシメルチニブに対する抵抗性の機序
第III相FLAURA試験に基づき、オシメルチニブは転移EGFR変異陽性NSCLCの一次治療の標準治療薬と目されるようになっている[12]。しかし、オシメルチニブに対する獲得抵抗性が課題であり、これまで体系的に特徴付けられていなかったことがその大きな要因である。第3世代EGFR TKIに対する抵抗性の機序を理解することが、次世代EGFR TKIと他剤の組み合わせに関する今後の開発にとって極めて重要である。
そのためPuriらは、オシメルチニブへの抵抗性の機序と考えられるものを特定するために、T790M変異がある転移NSCLC患者51例のゲノムプロファイルをレトロスペクティブに検討した[13]。患者51例のうち、35例はオシメルチニブによる治療を受けていた。予想通り、オシメルチニブによる治療を受けなかった患者16例の群に比べ治療をうけていた患者は有意に長いOSを示した(25.8ヶ月対4.34ヶ月;p=0.019)。オシメルチニブ治療中に進行性疾患を来した患者10例のゲノムプロファイリングによると、C797SまたはC797G変異、EGFR T790Mの喪失、EGFR増幅などのEGFR依存性の機序がが最も一般的であった(80 %)。さらに、EGFR非依存性機序が60 %で生じた。これにはHER2およびMETの増幅、副伝導路(例えば、MAPK/ERK経路)の活性化、およびその他(例えば、RET NCOA4融合、MYC増幅)が含まれた。各患者は、ゲノム検査時点で複数の抵抗性機序を示した。
T790M喪失は感受性の回復を示すものではない
Oxnardらも、オシメルチニブに対する抵抗性の機序の記述に重点を置いた[14]。Oxnardらはバリデーション目的のためのAURA試験からの血漿を用いて、事前のEGFR TKI治療に対する抵抗性が生じた後にオシメルチニブ単剤治療を受けたT790M陽性NSCLC患者から採取した腫瘍および血漿のジェノタイピングを行った。オシメルチニブ治療中に進行した患者33例のうち、11例がT790Mを維持し、22例が喪失した。オシメルチニブ抵抗性腫瘍の特徴と見なされるEGFR C797S変異は、T790M変異を維持した患者のみで検出された。T790Mを喪失した患者では、SCLCへの組織学的転換、MET増幅、またはPIK3CA変異を含む競合する抵抗性機序が生じた。T790M変異を喪失した患者はオシメルチニブに対する早期抵抗性を示し、治療不成功までの時間の中央値は6.9ヶ月であった。対照的に、C797S変異による抵抗性は治療過程の後半によく見られる。同時に、T790M変異の喪失はベースライン時血漿ジェノタイピングから予測することが困難である。T790M対立遺伝子の相対的割合は、T790M変異を維持した患者よりもT790M変異を喪失した患者でわずかに低いにとどまった。
T790M変異の喪失は第1世代EGFR TKI治療に対する感受性の回復を示すものではなく、競合する抵抗性変異の過剰な増加を示すこことが多いと著者は結論付けた。注意を要する稀な遺伝的抵抗性機序の範囲には、KRAS 変異、RET融合、およびEGFR融合が含まれる。進行時にT790Mを再試験すれば、抵抗性の生物学的な仕組みを解明するのに役立つかもしれない。早期抵抗性例を対象として、代替経路阻害薬(例えば、MET阻害薬)とオシメルチニブと組み合わせて評価する試験を検討することを著者は提案した。後期抵抗性を示した患者については、、維持されたEGFR依存による抵抗性が疑われるため、オシメルチニブと追加のEGFR阻害剤を併用する試験が適切かもしれない。
参考文献
- Tan WL et al., Clinical outcomes of patients with EGFR T790M+ NSCLC on osimertinib.WCLC 2017, P3.01-017
- Zhu L et al., The feasibility of osimertinib treatment on brain metastases in NSCLC patients after 1st generation EGFR-TKI resistance: a preliminary study.WCLC 2017, P1.01-046
- Kim JH et al., Efficacy of osimertinib for CNS metastases in advanced NSCLC: data from a Korea single center in ASTRIS, a real world treatment study.WCLC 2017, P3.01-028
- Zwicky Eide IJ et al., Osimertinib in relapsed EGFR-mutated non-small cell lung cancer patients with brain metastases: results from the TREM-Study.WCLC 2017, P2.03-035
- Yu HA et al., Analysis of tumor specimens at the time of acquired resistance to EGFR-TKI therapy in 155 patients with EGFR-mutant lung cancers.Clin Cancer Res 2013; 19: 2240-2247
- Sequist LV et al., Genotypic and histological evolution of lung cancers acquiring resistance to EGFR inhibitors.Sci Transl Med 2011; 3: 75ra26
- Yang JC-H et al., Osimertinib in pretreated T790M-positive advanced non-small-cell lung cancer: AURA study phase II extension component.J Clin Oncol 2017; 35: 1288-1296
- Wu SG et al., The mechanism of acquired resistance to irreversible EGFR tyrosine kinase inhibitor-afatinib in lung adenocarcinoma patients.Oncotarget 2016; 7: 12404-12413
- Hochmair MJ et al., Prevalence of EGFR T790M mutation in NSCLC patients after afatinib failure, and subsequent response to osimertinib.WCLC 2017, P2.03-025
- Mok TS et al., Osimertinib or platinum-pemetrexed in EGFR T790M-positive lung cancer.N Engl J Med 2017; 376: 629-640
- Sequist LV et al., Subsequent therapies post-afatinib among patients with EGFR mutation-positive NSCLC in LUX-Lung (LL) 3, 6 and 7.ESMO 2017 Congress, abstract 1349P
- Ramalingam SS et al., Osimertinib vs. standard-of-care EGFR-TKI as first-line treatment in patients with EGFRm advanced NSCLC: FLAURA.ESMO 2017 Congress, abstract LBA2_PR
- Puri S et al., Genomic profiling of EGFR T790M mutated non-small cell lung cancer to evaluate the mechanisms of resistance to osimertinib.WCLC 2017, MA 12.05
- Oxnard GR et al., Osimertinib resistance mediated by loss of EGFR T790M is associated with early resistance and competing resistance mechanisms.WCLC 2017, OA 09.02
More posts
化学療法:新しいアプローチ、新しいセッティング
化学療法:新しいアプローチ、新しいセッティング SCAT: BRCA1を用いた補助化学療法のカスタマイズ 最新ガイドラインでは、完全切除したリンパ節転移(ステージII~II
悪性中皮腫:ニンテダニブとチェックポイント阻害薬に関する最新データ
悪性中皮腫:ニンテダニブとチェックポイント阻害薬に関する最新データ 悪性胸膜中皮腫(MPM)は、未治療のままだと生存期間中央値が7~9ヵ月となる浸潤性腫瘍である[1]。切除
標的治療による扁平上皮細胞癌のアプローチ
標的治療による扁平上皮細胞癌のアプローチ アファチニブで予想される有益性 EGFR変異状況は、扁平上皮癌(SCC)組織構造を持つNSCLC患者においては日常的な検査の対象で
免疫療法:兆しが見えた新規バイオマーカーとピボタル床試験からのニュース
免疫療法:兆しが見えた新規バイオマーカーとピボタル床試験からのニュース 腫瘍変異負荷はSCLCに関係するか? 再発小細胞肺癌(SCLC)の患者については、使用できる治療選択
抗EGFR薬治療のさらなる使用:1次治療以降の治療
抗EGFR薬治療のさらなる使用:1次治療以降の治療 事前のEGFR TKI治療後のオシメルチニブ 一般に獲得抵抗性は一次EGFR TKI療法の続に生じ、その最も一般的な機序
「肺癌のより良い管理に向けて着実に進歩しています」
「肺癌のより良い管理に向けて着実に進歩しています」 Keunchil Park, MD, PhD 韓国ソウル、成均館大学校、サムスン医療センター、革新的癌医学研究所、血液/