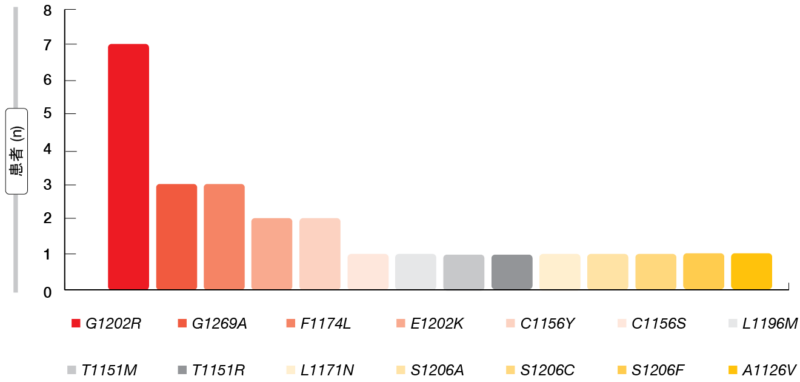KRAS、HER2和ALK:靶向选择和测序问题
采用sotorasib的深度缓解: CodeBreak 100
KRAS p.G12C突变是出现在大约13%的肺腺癌中的关键致癌驱动因素[1],并且与患者预后不良相关。同类首个高度选择性且不可逆的KRASG12C抑制剂sotorasib已在CodeBreaK 100研究的第一阶段中对59名经过大量先前治疗的NSCLC患者显示了持久的临床益处[2]。Li等人在2020年WCLC大会上介绍了来自注册性、开放标签、单组、II期CodeBreaK 100试验的NSCLC队列的结果[3]。在此部分研究中,来自11个国家的126名患有KRAS p.G12C突变型局部晚期或转移性NSCLC且在先前的标准疗法后疾病进展的患者每日口服 sotorasib 960 mg进行治疗,直至疾病进展。几乎所有患者要么目前吸烟,要么曾经吸烟。有一条先前全身抗癌疗法线者占42.9%,34.9%的患者接受了2条治疗线,22.2%的患者接受了3条治疗线。值得注意的是,有81%的患者在铂类化疗和PD-(L)1抑制剂治疗后进展。客观缓解率(ORR)构成主要终点。
在中位随访12.2个月后,确认的ORR为37.1%,分别有2.4%和34.7%的患者完全或部分缓解。疾病控制率为80.6%。81%的患者出现了不同程度的肿瘤缩小;在缓解者中,最佳肿瘤缩小的中位百分比为60%。此外,该试验证明了对sotorasib的早期且持久反应。达到客观缓解的中位时间和缓解的中位持续时间分别为1.4和10.0个月。数据截止时,有43%的缓解者仍在接受治疗且无进展。中位无进展生存期估计为6.8个月。
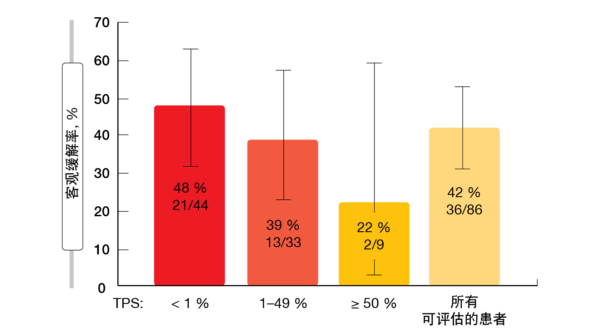
与治疗相关的不良事件通常较轻且易于控制,3级和4级事件的发生率较低(分别为19.8%和0.8%)。分别有7.1%和22.2%的患者需要治疗中断和剂量调整。最常报告的AE包括腹泻、恶心以及ALT和AST水平升高。根据CodeBreaK 100中包含的探索性生物标志物分析,对sotorasib的反应出现在PD-L1表达低或阴性的患者中(图1)且与STK11/KEAP1突变状态无关。比较sotorasib与二线多西他赛(docetaxel)的确认性III期CodeBreaK 200试验正在招募中(NCT04303780)。
图1: 根据PD-L1表达水平的对sotorasib疗法的反应
DESTINY-Lung01
在多种类型的肿瘤中,体细胞HER2突变的频率相对较低[4]。临床前模型表明,这些突变的一部分导致组成型激酶信号传导、致癌转化和增强的肿瘤生长[5]。开放标签、多中心、Ⅱ期DESTINY-Lung01研究旨在在经标准治疗后复发或标准治疗难治的、患有HER2阳性、不可切除/转移性非鳞状NSCLC患者中评估新型抗体-药物缀合物曲妥珠单抗德鲁替康(trastuzumab deruxtecan,T-DXd)。DESTINY-Lung01由纳入患有HER2过表达肿瘤的患者(n = 49)的队列1和纳入患有HER2突变疾病的患者的队列2(n = 42)组成。两个队列中的患者每3周接受T-DXd 6.4 mg/kg。在WCLC 2020上,Nakagawa等人介绍了队列1的中期结果[6]。
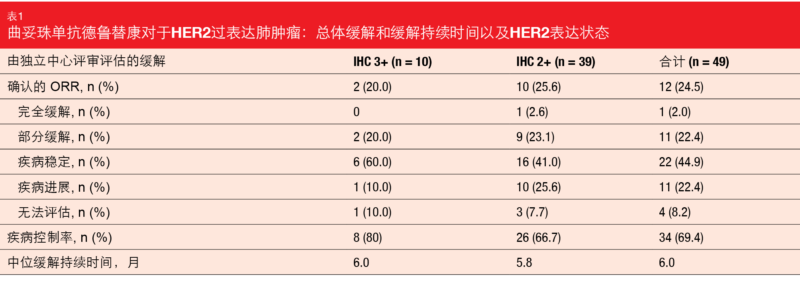
在该接受过中位三条治疗线的经大量先前治疗的HER2过表达NSCLC患者组中,T-DXd显示出抗肿瘤活性的证据。总体ORR为24.5%,HER表达无任何明显差异。对于IHC 3+和IHC 2+患者,ORR分别为20.0%和25.6%(表)。 1名患者得到CR(2.0%),疾病控制率达到69.4%。缓解持续中位6.0个月。中位PFS和OS分别为5.4个月和11.3个月。
作为相关问题的间质性肺疾病
安全特性总体上与先前试验的观察结果一致[7-11]。因药物相关的治疗后出现的不良事件(TEAE)导致剂量降低的情况占32.7%,而由于研究药物引起剂量中断的情况占12.2%。中性粒细胞计数减少是最常见的≥3级TEAE(20.4%),是剂量减少和中断的主要原因(各10.2%)。发生了8例(16.3%)的间质性肺病(ILD),其中观察到1、2和5级的病例分别占4.1%、 6.1%和6.1%。在ILD情况下报告的三例死亡中,一名患者的死亡原因是肺炎。总体而言,至药物相关ILD发作的中位时间为64.5天。所有病例均退出治疗, 2级和5级ILD患者使用了类固醇。作者在其结论中指出,DESTINY-Lung01中注意到的令人鼓舞的疗效结果支持在HER2过表达NSCLC患者中正在进行的T-DXd探索。将在研究中继续密切监视和积极管理ILD,随着更多后续数据的获得,将进行进一步的调查。
Smit等人报告了DESTINY-Lung01试验的队列2的发现,该队列2纳入了42名HER2突变的晚期NSCLC患者[12]。 在该组中,ORR为61.9%,疾病控制率为90.5%。证明缓解是持久的,分析时尚未达到缓解的中位持续时间。中位PFS为14.0个月。对于队列1,安全特性大体与以前的报告相符。没有发生高级ILD事件。作者认为,这些数据证明,对于需求远未满足的HER2突变型NSCLC患者,T-DXd具有成为新治疗选择的潜力。HER2突变队列扩大招募了50名患者,以便更好地在该组中表征T-DXd以及进一步支持正在进行的临床试验计划。
来那替尼(neratinib) 单独和联合使用
口服的不可逆TKI来那替尼可靶向EGFR、HER2和HER4[13]。研究表明,它在多种HER2突变和肿瘤类型中均表现出临床活性,其敏感性既依赖于组织学,又依赖于突变背景[14]。两项国际化II期试验评估了来那替尼在HER2突变型肺癌患者中的活性。PUMANER-4201在未经治疗或经治疗的IIIB/IV期HER2突变型NSCLC患者中,随机比较了来那替尼240 mg/d (n = 17)和来那替尼240 mg/d联合mTOR抑制剂替西罗莫司(temsirolimus)8 mg/周(n = 43)。开放标签的篮式SUMMIT试验(PUMA-NER-5201) 包含HER2突变肺癌患者的贯序开放标签队列,这些患者尚无治疗方法;他们接受了单独的来那替尼(n = 26)或来那替尼加曲妥珠单抗(trastuzumab)8 mg/kg,然后每周三次 6 mg/kg(n = 52)。在两项研究中,外显子20的小框内插入都是最常见的HER2突变类型(在PUMA-NER-4201和SUMMIT中分别为95%和67%)。Li等人介绍了在试验中获得的结果[15]。
分析表明,单药来那替尼在HER2突变型NSCLC中的活性有限。对于4201和SUMMIT中纳入的单药治疗队列,ORR分别为0%和4%。替西罗莫司和曲妥珠单抗的组合产生数值较高的ORR,分别为14%和8%。其中证明,在经先前治疗的患者亚组中的缓解是持久的,分别持续长达22.6个月和18.3个月。来那替尼加替西罗莫司的中位OS最长,为15.1个月。
腹泻是最常见的AE,在所有队列的> 80%的患者中发生不同等级的腹泻事件。据报告,≥3级腹泻的比例高达40%。但是,很少有降低剂量和永久性停药的情况。其他AE包括恶心、呕吐、便秘和疲劳。作者指出,正在考虑将来那替尼与其他HER2定向疗法的其他新组合用于HER2突变型NSCLC。
ARIA
在ALK阳性NSCLC患者中,对ALK TKI疗法的耐药机制的检测可能有助于选择后续治疗。ARIA研究基于通过液体活检获得的循环肿瘤DNA(ctDNA)中ALK抗性突变的存在,研究了新一代ALK TKI的活性[16]。该分析纳入了欧洲9个地区的58名患者,他们患有ALK阳性晚期NSCLC且接受过第一代和/或第二代ALK TKI先前治疗。在将要开始布加替尼(brigatinib)或劳拉替尼(lorlatinib)疗法之前采集液体活检物。根据三种ctDNA分子组评估这两种药物的活性:
- ALK突变者(仅1个突变:单个;≥2个突变:复杂)
- 非ALK突变者
- 无可检测突变者。
在58名可评估患者中,分别有16名和42名接受了布加替尼和劳拉替尼。在这些亚组中,先前用克唑替尼(crizotinib)治疗者占94%和74%;先前用第二代ALK TKI治疗者的百分比分别为69%和98%。大多数患者显示两个以上的转移部位,颅内病变出现分别在88%和71%的患者中。
总体而言,在16(28%)名患者中检测到ALK突变;其中9名是单个突变,7名是复杂突变。在17%的患者中发现了其他突变,55%的患者未发现突变。ALK突变多种多样,最常见为G1202R,其次是G1269A和F1174L (图2)。每个样品中发现了1-6个突变。16名ALK突变患者中有5名曾接受艾乐替尼(alectinib),另有5名采用色瑞替尼(ceritinib)治疗,6名采用布加替尼治疗。
图2: 通过液体活检评估的ALK突变的亚型
根据ALK抗性突变得到的结果
不管属于哪种ctDNA分子组,随后用劳拉替尼进行的治疗均显示出活性。在ALK突变(n = 13;6.5个月)、其他突变(n = 7;7.6个月)和无突变(n = 22; 7.3个月)的患者中,中位PFS相当。 ORR分别为46%、71%和23%,而CNS中的ORR分别为56%、60%和67%。三组的中位OS分别为62.6个月、45.0个月和未达到。
相比之下,在ALK突变组中观察到的布加替尼的结果较差,但有关该队列的结论是受限的,因为该队列仅包含3个个体,患者人数总体较少。中位PFS为3.5个月,而其他突变组为6.2个月(n = 3),无突变组为8.1个月(n = 10)。ORR分别为0%、67%和22%,CNS缓解率分别为0%、100%和50%。中位OS分别为38.4个月、62.6个月和未达到。汇总这些结果,作者强调说,需要对第二代TKI疗法的最近前期使用进行类似的研究方可确认ctDNA是否可能是指导序贯治疗的生物标志物。
参考文献
- Biernacka A et al., The potential utility of re-mining results of somatic mutation testing: KRAS status in lung adenocarcinoma. Cancer Genet 2016; 209(5): 195-198
- Hong DS et al., KRASG12C inhibition with sotorasib in advanced solid tumors. N Engl J Med 2020; 383: 1207-1217
- Li BT et al., CodeBreaK 100: registrational phase 2 trial of sotorasib in KRAS p.G12C mutated non-small cell lung cancer. WCLC 2020, PS01.07
- Cousin S et al., Targeting ERBB2 mutations in solid tumors: biological and clinical implications. J Hematol Oncol 2018; 11(1): 86
- Bose R et al., Activating HER2 mutations in HER2 gene amplification negative breast cancer. Cancer Discov 2013; 3(2): 224-237
- Nakagawa K et al., Trastuzumab deruxtecan in HER2-overexpressing metastatic non-small cell lung cancer (NSCLC): interim results of DESTINY-Lung01. WCLC 2020, OA04.05
- Tsurutani J et al., Targeting HER2 with trastuzumab deruxtecan: a dose-expansion, phase I study in multiple advanced solid tumors. Cancer Discov 2020; 10(5): 688-701
- Tamura K et al., Trastuzumab deruxtecan (DS-8201a) in patients with advanced HER2-positive breast cancer previously treated with trastuzumab emtansine: a dose-expansion, phase 1 study. Lancet Oncol 2019; 20(6): 816-826
- Modi S et al., Trastuzumab deruxtecan in previously treated HER2-positive breast cancer. N Engl J Med 2020; 382(7): 610-621
- Modi S et al., Antitumor activity and safety of trastuzumab deruxtecan in patients with HER2-low-expressing advanced breast cancer: results from a phase Ib study. J Clin Oncol 2020; 38(17): 1887-1896
- Shitara K et al., Trastuzumab deruxtecan (DS-8201a) in patients with advanced HER2-positive gastric cancer: a dose-expansion, phase 1 study. Lancet Oncol 2019; 20(6): 827-836
- Smit EF et al., Trastuzumab deruxtecan in HER2-mutated metastatic non-small cell lung cancer (NSCLC): interim results of DESTINY-Lung01. WCLC 2020, MA11.03
- Wissner A & Mansour TS, The development of HKI-272 and related compounds for the treatment of cancer. Arch Pharm Chem Life Sci 2008; 341(8): 465-477
- Hyman DM et al., HER kinase inhibition in patients with HER2- and HER3-mutant cancers. Nature 2018; 554(7691):189-194
- Li BT et al., Neratinib-based combination therapy in HER2-mutant lung adenocarcinomas: findings from two international phase 2 studies. WCLC 2020, FP14.15
- Mezquita L et al., The ARIA study: Activity of next-generation ALK TKIs based on ALK Resistance mutations detected by liquid biopsy in ALK positive NSCLC patients. WCLC 2020, P84.01
© 2020 Springer-Verlag GmbH, Impressum