多岐にわたる遺伝子変異をターゲットにする新規治療薬や既存の治療薬
抗HER2療法
DESTINY-Lung01試験:T-DXdの確固たる効果
HER2変異は非扁平上皮NSCLCに顕著なドライバー遺伝子変異のおよそ3%を占める[1、2]。NSCLCを適応症に承認を受けたHER2阻害薬はいまだ限ら
れているものの、抗HER2抗体薬物複合体のトラスツズマブデルクステカン(T-DXd)が別のがん種のHER2遺伝子変異陽性例に適応する薬剤として、複数の国で承認されている。2つのコホートを対象にした第Ⅱ相国際共同DESTINY-Lung01試験では、転移巣を認め、標準治療で再発したまたはそれに抵抗性の病変があるHER2過剰発現患者と、同じくHER2遺伝子変異陽性患者へのT-DXdの効果を調べた。同試験に参加し、T-DXd 6.4 mg/kgを3週間おきに投与した91人のHER2遺伝子変異陽性群(コホート2)全員のデータに行った一時解析結果を、LiらがESMO 2021で発表した。このうちの約95%がプラチナ製剤ベースの化学療法を、65.9%が抗PD-(L)1抗体薬の投与を、62.6%が両方を受けていた。
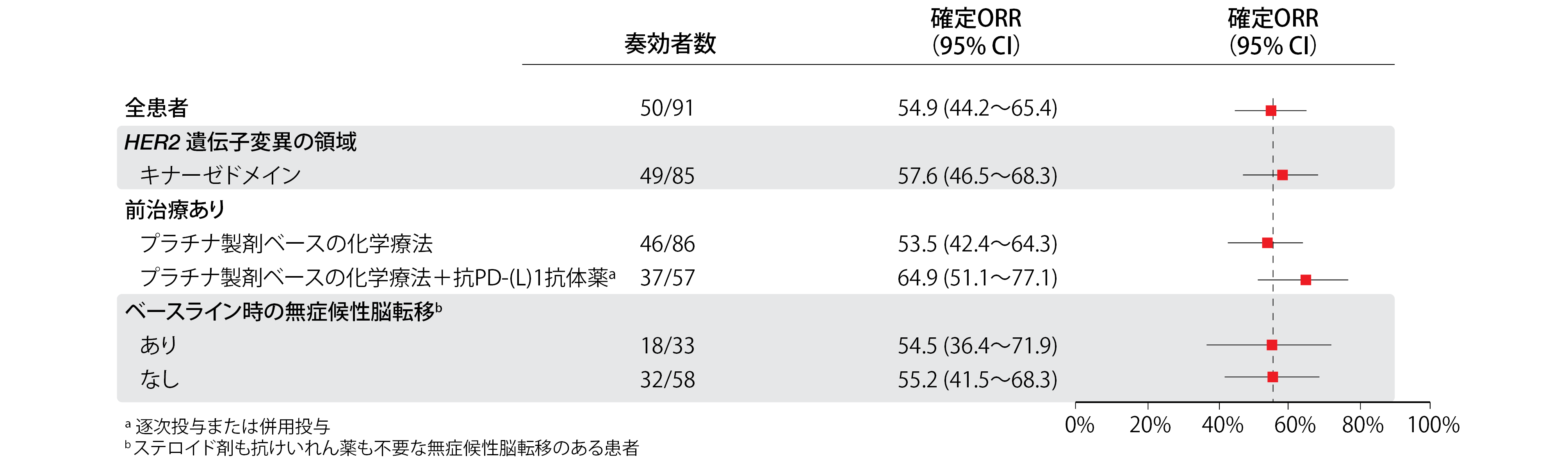
T-DXdはどちらの療法を受けたことのある患者にもしっかりと安定した抗腫瘍作用を示した。奏効率(ORR)は54.9%になり、92.3%に臨床的有用性が認められた。CNS病変が安定している患者群も含めてどのサブグループにも奏効しており(図1)、奏効期間の中央値は9.3か月間となっていた。探索的データ解析からは、多岐にわたるHER2遺伝子変異のサブタイプ全体だけでなく、検出可能なHER2遺伝子変異もHER2遺伝子増幅もない患者に対しても抗腫瘍作用のあることが示されている。無増悪生存期間(PFS)の中央値は8.2か月に、全生存期間の中央値は17.8か月にのぼった。
試験薬投与後に発現したAE(TEAE)で投与中止の原因としてとりわけ多かったのは、試験担当医師が報告した間質性肺炎(13.2%)と間質性肺疾患(ILD、5.5%)だった。薬剤が関係すると判断したILDや間質性肺炎の75%はグレード1または2だったが、早期発見と効果の高い方法による早期治療が必要になる、注意すべき危険因子であることに変わりはないと著者らは指摘した。減量が必要になるTEAEが34.1%に発現し、悪心(11.0%)と疲労(8.8%)がその中心だった。
T-DXdは二次治療やそれ以降の治療ラインで使用する薬剤として、ベネフィットとリスクのバランスがとれていることを同試験が証明したと著者らが総括する中でそう述べており、T-DXdが新たな標準治療薬になりうることをデータが裏付けている。一方、HER2遺伝子変異陽性NSCLC患者への至適投与量を確立できるように、5.4 mg/kgの用量についてDESTINY-Lung02試験で検証が続いている。
図1:HER2遺伝子変異陽性NSCLC患者のサブグループ全体に共通して認められたトラスツズマブデグルデカンの奏効率・奏効期間
HER2エクソン20挿入遺伝子変異陽性例へのポジオチニブ使用
EGFRやHER2のエクソン20挿入遺伝子変異、両遺伝子のまれな変異、オシメルチニブでの治療の不成功例といった様々なコホートを対象に、国際共同マルチコホートZENITH20試験で汎HERチロシンキナーゼ阻害薬(TKI)のポジオチニブの有効性と安全性を評価している。同試験のコホート4のHER2エクソン20挿入遺伝子変異陽性患者にポジオチニブを一次治療で投与して調査をした。このうちの48人に16 mgを1日1回投与しているが、8 mgを1日2回投与する23人の群への患者の募集はまだ終わっていない。CornelissenらはESMO 2021で、コホート4の1日1回投与群に関する暫定的な有効性と安全性のデータを報告した[4]。
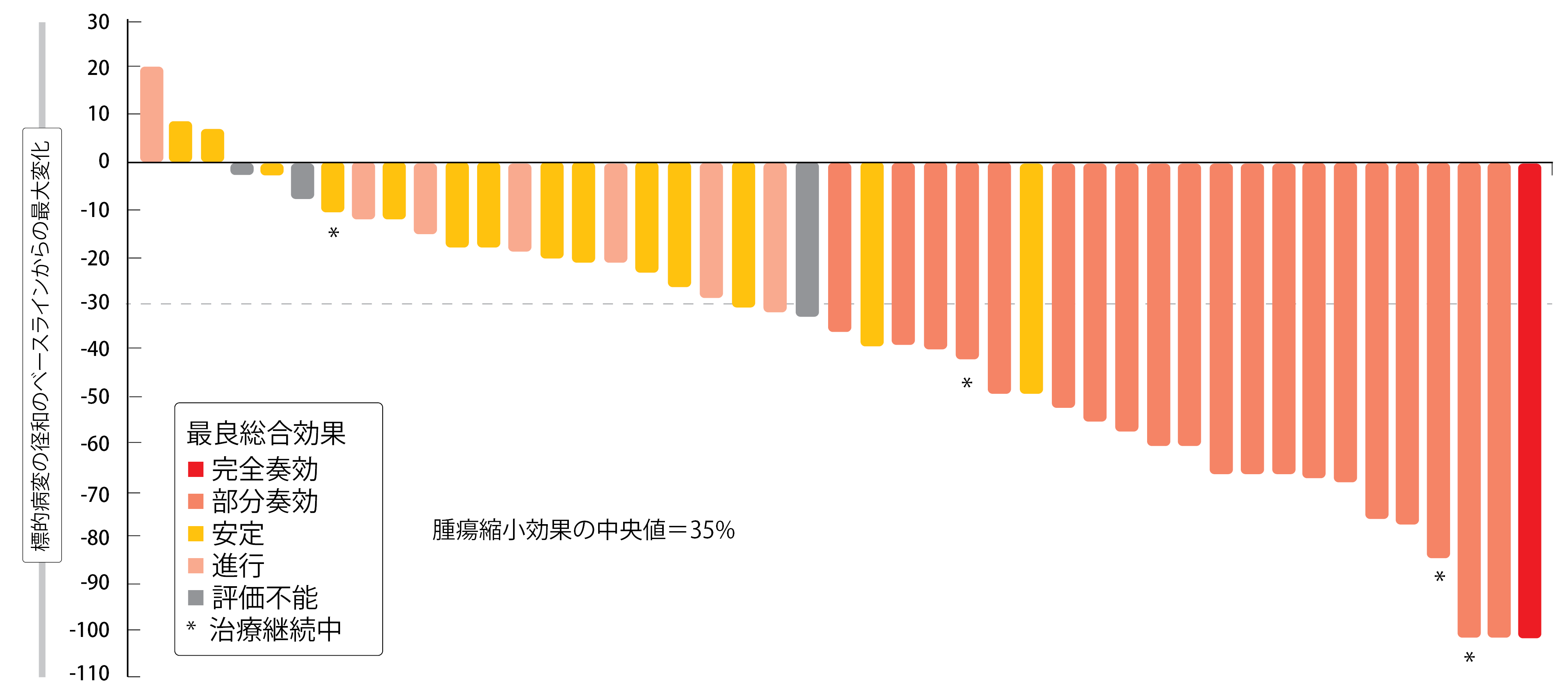
独立中央画像判定委員会が判定した、主要評価項目である奏効率の確定値は43.8%に、病勢コントロール率は75.0%になり、患者の88%で腫瘍が縮小していた(図2)。PFSの中央値は5.6か月で、26%の患者が12か月以降も生存しており、増悪もみられなかった。奏効期間の中央値は5.4か月となり、最長期間は19.1か月を超えていた。ポジオチニブの毒性プロファイルは治療可能な内容で、過去にポジオチニブを評価した試験や第二世代のEGFR TKIと差異はなかった。下痢、発疹、口内炎がAEの発現の多さでは上位を占め、AEの発現により77%に減量が必要になり、13%が投与中止に至った。全体的に見ると、HER2エクソン20挿入遺伝子変異陽性NSCLCの未治療の患者には、ポジオチニブの1日1回投与に臨床的意義があった。
図2:ポジオチニブを投与したHER2エクソン20挿入変異陽性患者のベースラインからの腫瘍縮小効果
EGFRとMETの二重特異性抗体:アミバンタマブ
コンパニオン診断およびラゼルチニブとの併用療法
プラチナ製剤ベースの化学療法の実施中もしくはその後に病勢進行の判定を受けた、EGFRエクソン20挿入変異陽性NSCLC患者に対する、EGFRとMETを標的にした二重特異性抗体のアミバンタマブの使用が、現在実施中の第I相CHRYSALIS試験の成績をもとに米国で承認を受けた。同試験では、アミバンタマブの単独療法と第三世代のEGFR TKIのラゼルチニブとの併用療法を、多様な設定で評価している。EGFR20エクソン挿入変異の検出について、血漿検体を用いるGuardant360® CDx、がん組織検体を用いるOncomine™ Dx Target TestというNGSを用いた2種類のコンパニオン診断システムの実用性を臨床で検証するために、ブリッジング試験が行われた。 WCLC 2021で発表があった両システムの成績はどちらも細かな部分まで一致しており、アミバンタマブ療法が適した患者の正確な特定に役立てられることが示された[5]。
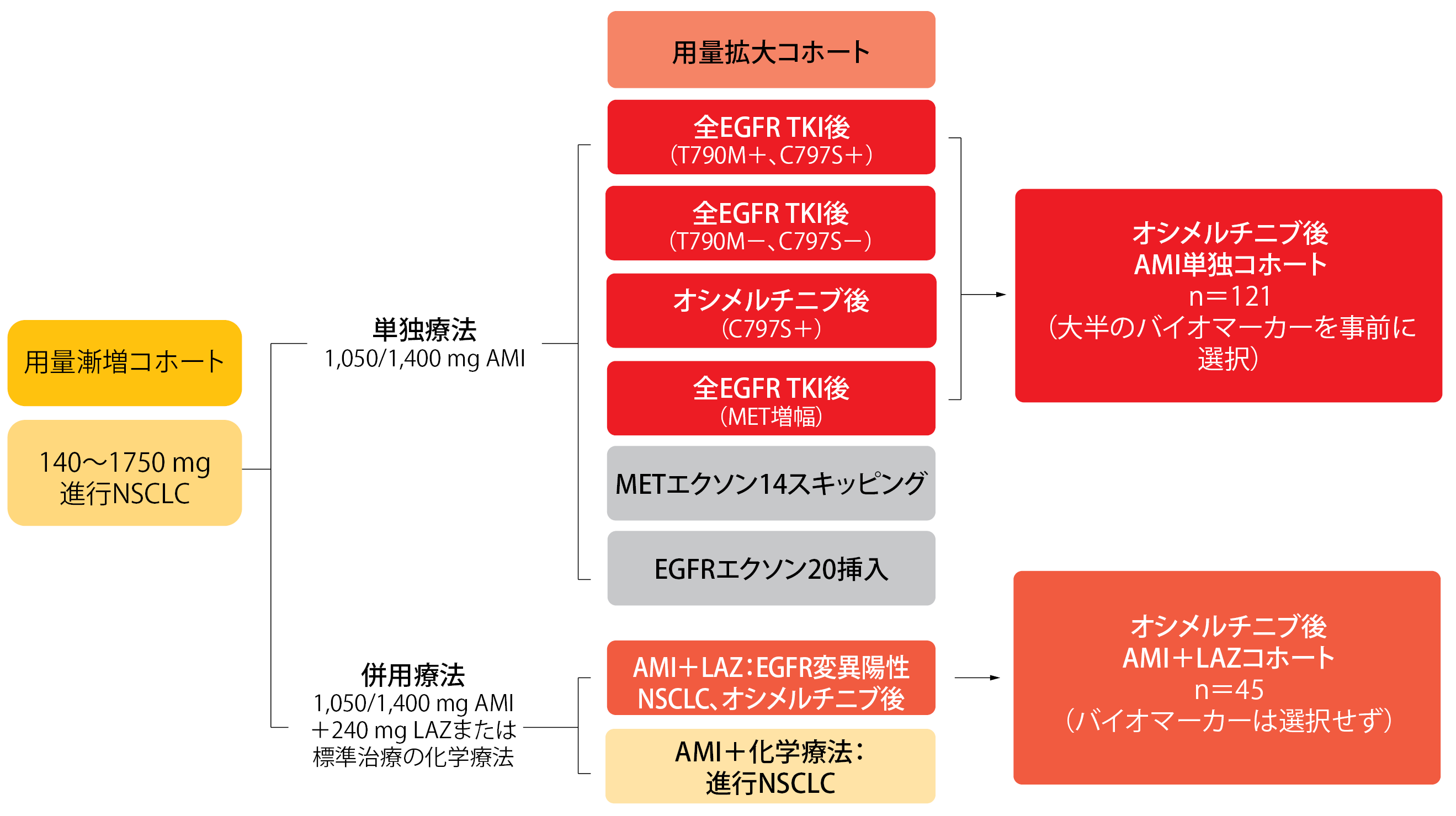
オシメルチニブが無効に終わった後、アミバンタマブにラゼルチニブの追加が奏効したCHRYSALIS試験でのデータを、LeighlらがESMO 2021で報告した[6]。アミバンタマブとラゼルチニブを併用投与するコホートは45人、アミバンタマブを単独投与するコホートは121人で(図3)、単独投与群よりも併用投与群に高い抗腫瘍作用がみられた。ラゼルチニブを併用したことでアミバンタマブを単独投与するよりもORRが高くなり(併用群は36%、単独群は19%)、奏効期間も延び(同9.6か月、同5.9か月)、この期間が6か月以上続いたのはそれぞれ患者の69%と39%になった。併用群でのCNS病変が進行した率が7%と、単独群の17%よりもさらに低くなったことから、どちらの群にも進行を抑制する効果があったと考えられる。
両群の安全性プロファイルは過去に報告のあった内容と一致していた。EGFR遺伝子変異陽性NSCLCの複数の患者集団を対象に、アミバンタマブとラゼルチニブの併用投与の有効性・安全性をCHRYSALIS-2試験そして第Ⅲ相MARIPOSA試験で調査している。
図3:アミバンタマブ(AMI)単独とラゼルチニブ(LAZ)との併用を比較検討したCHRYSALIS試験のデザイン
MET遺伝子エクソン14スキッピング変異陽性NSCLCに関する知見
CHRYSALIS試験に参加したMET遺伝子エクソン14スキッピング(METex14)変異陽性NSCLC患者に関する、アミバンタマブの初期成績をSpira らが報告した[7]。この変異はNSCLC患者のおよそ3%に発現しており[8]、MET TKIが有効であるものの耐性獲得が大きな課題になっている。同試験ではまだMETex14スキッピング変異陽性患者を募集しているが、解析対象になったのは標準治療後に病勢進行したあるいは標準治療を受け入れなかった、転移がある患者や切除不能な患者19人である。
アミバンタマブを投与した、奏効状態の評価が可能な14人のうち9人(64%)が部分奏効に至ったが、判定が確定したのが5人、保留のままが4人だった。治療経験のない患者にもある患者にも効果が示された。この中にはMET TKIの治療を受けたことのある7人が含まれており、このうち2人が耐性を獲得したと考えられた。奏効期間の中央値はまだ判明していなかったが、奏効状態の評価が可能な14人のうち11人がまだ治療を受けていた。
このサブグループにみられたアミバンタマブの安全性プロファイルは、EGFR遺伝子変異陽性NSCLC患者のものと同様な内容だった。EGFR変異とMET変異のどちらにも単独投与の効果があったことから、アミバンタマブは両方の変異にも有効なことが、METex14スキッピング変異陽性NSCLC患者から得た初回成績で確認できたと著者らは語った。
抗c-MET抗体薬物複合体のテリソツズマブベドチン
c-METタンパク質が過剰発現している局所進行性NSCLCおよび転移性NSCLCで治療歴がある患者を対象に、抗c-MET抗体薬物複合体の画期的新薬であるテリソツズマブベドチンの有効性・安全性を、現在進行中の第Ⅱ相単群二段階アダプティブ試験で評価している。組織型とEGFR遺伝子変異の発現状況をもとに分けた、扁平上皮がんコホート、非扁平上皮がん+EGFR遺伝子変異陽性コホート、非扁平上皮がん+野生型EGFR遺伝子コホートの3コホートが試験対象である。 非扁平上皮がんの2コホートはさらに、c-METタンパク質の発現量が多いサブグループと中程度のサブグループに分けた。次の段階ではORRを基準にして拡大期に進む患者を判断した。テリソツズマブベドチン1.9 mg/kgを1週間おきに投与した。
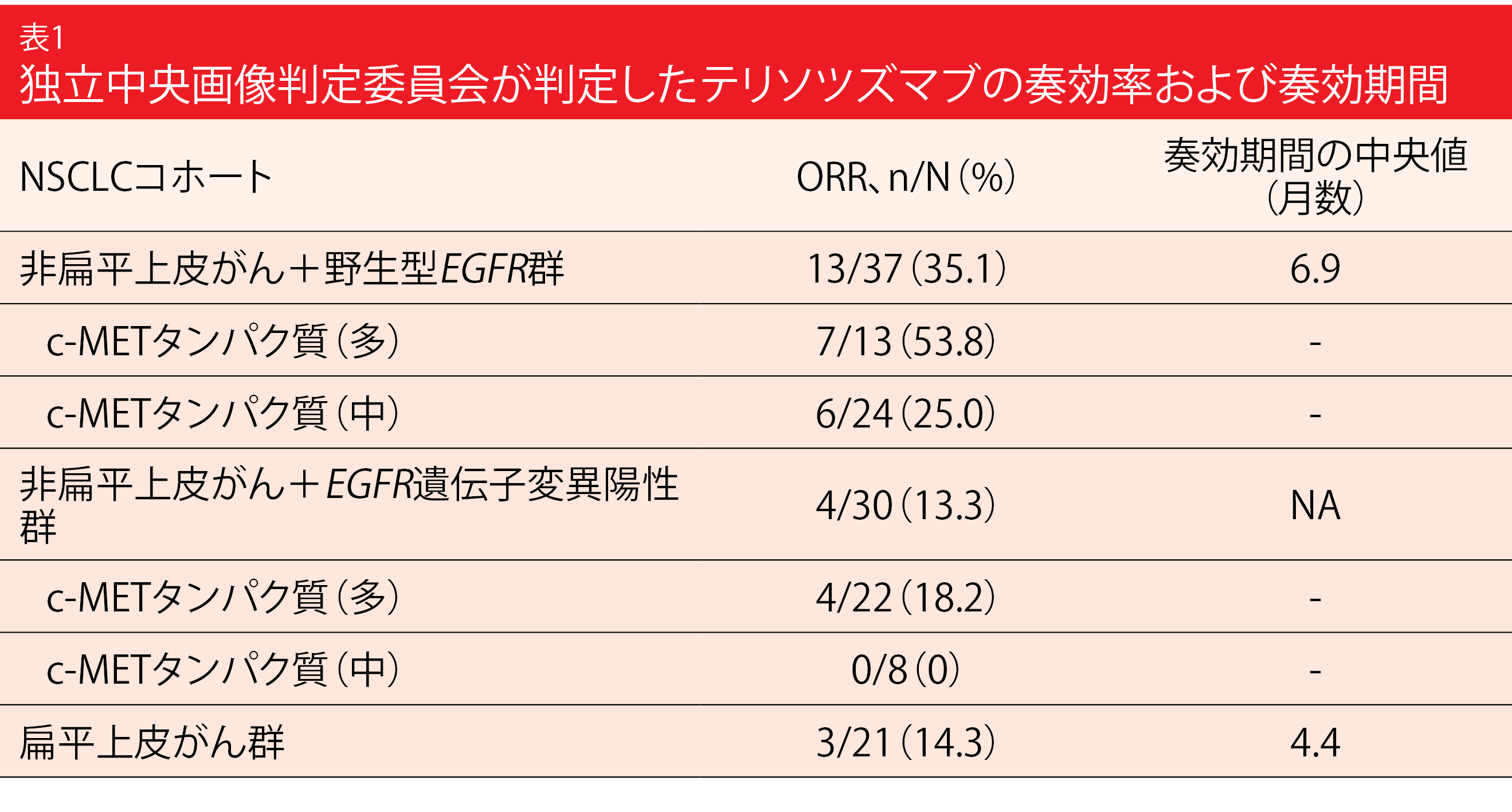
非扁平上皮がん+野生型EGFR遺伝子コホートの37人、非扁平上皮がん+EGFR遺伝子変異陽性コホート31人、扁平上皮がんコホート22人に関する中間解析結果を、CamidgeらがESMO 2021で報告した[9]。c-METタンパク質の発現量をHスコアで表すと、野生型EGFR遺伝子コホート(中央値は225)がEGFR遺伝子変異陽性コホート(同265)よりも低くなったが、最も低くなったのは扁平上皮がんコホート(同164)だった。非扁平上皮がん+EGFR遺伝子変異陽性コホートの大半の患者でc-METタンパク質の発現量が多くなっていたのに対して(71%)、野生型EGFR遺伝子コホートでは中程度だった(65%)
非扁平上皮がん+野生型EGFR遺伝子コホートのORRが35.1%にのぼり、テリソツズマブベドチンの効果に期待が持てることが示された(表1)。このコホートのc-METタンパク質の発現量が多い患者群のORRが53.8%ということで、全コホートのうちで最高になったが、発現量が中程度の患者群のORRにも臨床的意義が認められている。この結果を受け、既定の基準に照らして次の段階ではこのコホートを拡大することになった。なお、これ以外のコホートでもある程度、奏効している。試験薬投与後に発現した重篤なAE(TEAE)で発現率が最高レベルになったのは肺炎(5%)、悪性新生物進行(4%)、間質性肺炎 4%)で、グレード3以上のTEAEが患者の44%に生じた。扁平上皮がんコホートの募集は終了したが、非扁平上皮がん+EGFR遺伝子変異陽性コホートの募集は次回の中間解析まで続く予定である。
EGFRエクソン20挿入変異
TKIによる治療成功後のモボセルチニブ使用
EGFRエクソン20挿入変異をターゲットにしたEGFR TKIのモボセルチニブは、第I相試験と第Ⅱ相試験の暫定結果を受けて、プラチナ製剤ベースの化学療法の実施中あるいは実施後に病勢が進行したNSCLC患者(米国の場合)や、化学療法の後にそうなった患者(中国の場合)を対象にした治療薬として、ブレークスルーセラピー指定を受けている[10]。第I相試験・第Ⅱ相試験で受けたEGFR TKIの治療によって奏効または安定が6か月以上続いた後に、病勢が進行した患者で構成した拡大コホートに関する有効性と安全性のデータを、SpiraらがESMO 2021で発表した[11]。患者20人にモボセルチニブ160 mgを1日1回投与した。使用歴のあるチロシンキナーゼ阻害薬はポジオチニブ、オシメルチニブ、アファチニブ、エルロチニブである。患者の55%に直近に投与されたEGFR TKIは、ポジオチニブ(n=7)、オシメルチニブ(n=3)、治験中のTKI(n=3)で、投与期間の中央値は7.8か月だった。
モボセルチニブはこの患者群に臨床的意義のあるベネフィットをもたらした。中央値の14.2か月追跡したところ、確定ORRは40%、病勢コントロール率は90%にのぼり、奏効期間の中央値は13.0か月、PFSの中央値は7.3か月、OSの中央値は判明していなかった。12か月後でも患者の78.6 %が生存していた。安全性プロファイルについては第I相試験・第Ⅱ相試験の他の患者群から得た内容とよく似ており、様々なEGFR TKIの安全性プロファイルと一致していることも、解析結果から見て取れた。全グレードの治療関連AEのうち下痢の発現率が最高になったが(90%)、グレード3以上の下痢が生じたのはわずか1人だった。AEが原因で4人(20%)に投与量の減量が必要になり、2人(10%)が投与中止を余儀なくされた。EGFR TKIを用いた治療で奏効の判定を受けた患者も含め、EGFRエクソン20挿入変異陽性の転移性NSCLC患者への治療薬として、モボセルチニブは期待がもてる存在だと著者らは結論づけた。
新規阻害薬のDZD9008
EGFRやHER2の遺伝子変異が陽性のNSCLC患者への治療薬として、選択的かつ不可逆的なチロシンキナーゼ阻害薬のDZD9008が開発されている。複数の治療歴がある、EGFRエクソン20挿入変異陽性患者の異なるサブタイプに対して、DZD9008が今後に期待できる抗腫瘍作用を現在実施中のWU-KONG1、WU-KONG2の両第I相試験で示した[12]。両試験では用量漸増期と用量拡大期に複数のコホートが組み入れられ、WU-KONG1試験には食事の影響を調べるコホートも組み入れられた。安全性解析対象者は102人で、WU-KONG1、WU-KONG2のどちらかの試験で50 mgから400 mgのDZD9008の1日1回投与を1度以上受けた患者とした。有効性解析対象者は56人で、EGFRエクソン20挿入変異が陽の性、50 mgから400 mgのDZD9008を1日1回投与し、治療後にRECISTに基づいて1回以上治療効果判定を受けた患者とした。このうちの18人が用量漸増コホート、38人が用量拡大コホートになった。
薬物動態の特性も良好で、DZD9008 の半減期は約50時間となり、とりわけ高脂肪食品を摂食しても薬物動態に明らかな影響はみられなかった。すべての用量群の抗腫瘍作用を確定ORRで表すと、用量漸増コホートは22.2%、用量拡大コホートは44.7%になった。ベースライン時の脳転移の有無とEGFRエクソン20挿入変異のサブタイプにかかわらず、用量100 mg以上で有効性が認められた。治療期間は最長で17か月を超え、解析の時点ではPFSの中央値は判明していなかった。忍容性は良く、AEも治療可能なものだった。グレード3以上の治療関連AEは用量群全体で33.3%になり、その発現により減量が必要になったのは15.7 %、投与中止が必要になったのは5.9 %だった。治療歴のあるEGFRエクソン20挿入変異陽性NSCLC患者を対象に、DZD9008の第Ⅱ相試験が現在行われている。
EGFR TKIとベバシズマブの併用療法
BEVERLY試験:エルロチニブ
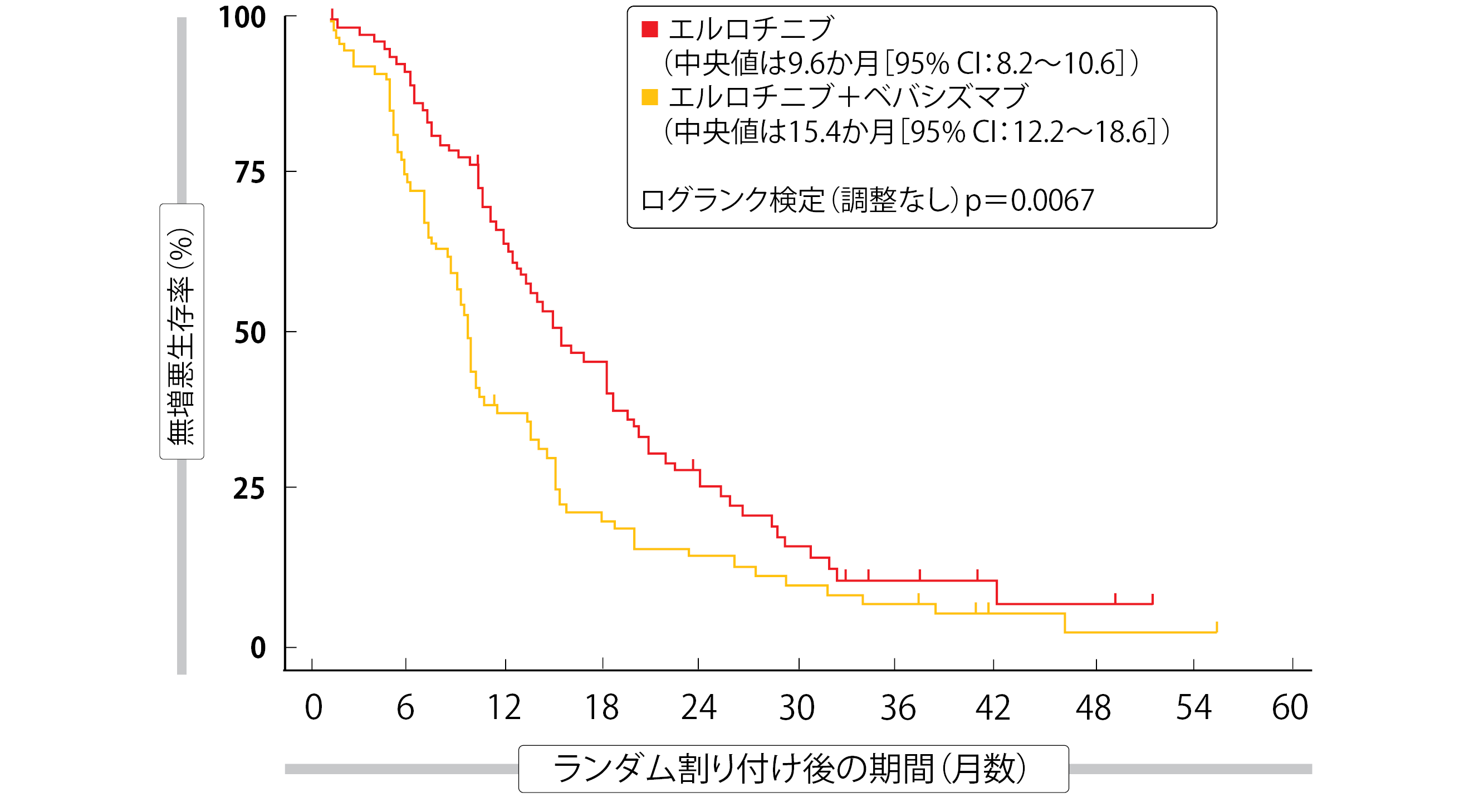
VEGF阻害薬を第1世代のEGFR TKIに加えると、EGFR遺伝子変異陽性非扁平上皮NSCLC患者のPFSに延長効果をもたらす可能性のあることが、臨床試験で示されている[13~15]。第Ⅲ相多施設共同ランダム化比較BEVERLY試験で、ⅢB期またはIV期のEGFR遺伝子変異陽性NSCLC患者への一次治療として、抗VEGF抗体のベバシズマブとエルロチニブの併用療法を調査している。エルロチニブ150 mgの1日1回投与とベバシズマブ15 mg/kgの3週間間隔投与の併用群と、エルロチニブの単独投与群に、合計160人の患者を1対1の割合でランダムに割り付けた。
エルロチニブの単独投与群に比べると、ベバシズマブとの併用投与群でPFS(併用群15.4か月、単独群9.6か月、HR:0.66、p=0.015、図4)およびORR(同70%、同50%、 p=0.01)が統計的有意に延長していたが、OSも延長はしていたものの統計的有意性はなかった(同33.3か月、同22.8か月、HR:0.72、
p=0.132)[16]。PFSとOSの探索的サブグループ解析によると、併用投与のベネフィットが顕著に現れるのは禁煙者と喫煙者と思われた。
QoLデータを解析したところ、EORTC C30-LC13の調査票のどの項目をとっても両群に統計的有意差は認められなかった。全体的な健康状態と生活の質が低下するまでの期間については、併用投与群で単独投与群よりも若干良い結果が出ていたが、統計的有意差はなかった。安全性に予想外の問題が生じることはなかったが、併用投与群で重度の高血圧と発疹の発現率が高くなっていた。著者らが述べたように、ベバシズマブとエルロチニブの併用はオシメルチニブを投与できない患者への一次治療の選択肢になりうるが、さらに検討を重ねる必要がある。
図4:BEVERLY試験でエルロチニブにベバシズマブを併用した際の無増悪生存期間・率
WJOG9717L試験:オシメルチニブ
ベバシズマブを別のEGRF TKIと併用しても、WJOG9717L試験ではベネフィットがみられなかった[17]。同試験ではオシメルチニブ80 mgの1日1回投与とベバシズマブ15 mg/kgの3週間間隔投与を併用する群(n=61)を、オシメルチニブ単独投与群(n=61)と比較した。PFS(併用投与群22.1か月、単独投与群20.2か月、p=0.213)、ORR(同82%、同86%)、OS(HR:0.970)のいずれでも併用投与群に単独投与群を上 回る改善が認められなかったものの、
喫煙経験者やエクソン19欠失変異陽性患者には、ベバシズマブの追加がPFSを延長させる可能性のあることがサブグループ解析で示された(HRは0.481と0.622)。有害事象解析によると、2剤を併用したことでオシメルチニブによる間質性肺炎の発現頻度は減少したかもしれないが、高血圧、鼻血、蛋白尿が併用投与群ではるかに多く発現している。
アファチニブの使用に関するリアルワールド試験
UpSwinG試験:投与順序に関する試験
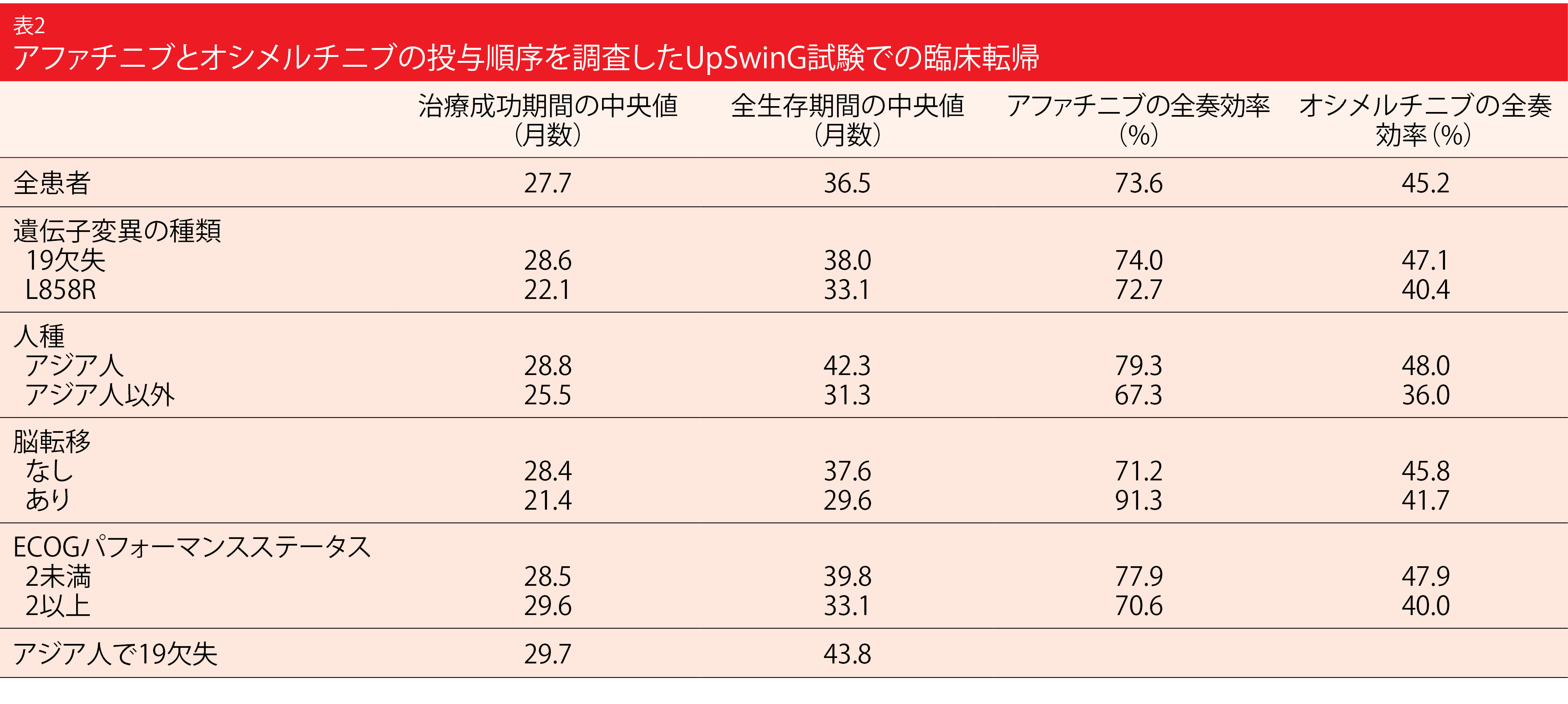
EGFR遺伝子変異陽性NSCLC患者の場合、一次治療の薬剤に耐性が生じると、二次治療に使用できる薬剤の有無や治療の開始時期によって、生存転帰が大きく左右される。アファチニブへの耐性獲得にT790M遺伝子変異の関わりがあることが全体の50~70%ほどに認められていて[18]、同遺伝子変異のオシメルチニブ感受性が非常に高いことから、アファチニブとオシメルチニブを順に投与すれば、投与期間を最大限延長できる可能性がある。そこで、国際共同非介入試験のUpSwinG試験では、日常の臨床で一次治療にアファチニブを、二次治療にオシメルチニブを投与した患者で、T790M遺伝子変異による耐性を獲得した患者の転帰をカルテから収集して分析した。主にアジア人と女性患者が占めた191人の分析結果がWCLC 2021で報告された[19]。脳転移を認めたのはこのうちの約14%である。
治療期間の中央値はアファチニブが15.1か月、オシメルチニブが9.5か月で、患者の半数近くがオシメルチニブの後の治療ラインを1つ以上受けており、大半が化学療法だった(84.5%)。主要評価項目の治療成功期間は27.7か月、OSの中央値は36.5か月にのぼった(表2)。ECOG PSが2以上の患者や脳転 移のある患者といったサブグループ全体でこれらの結果は共通していた。 アジア人患者群(42.3か月)とエクソン19欠失変異のあるアジア人患者群(43.8か月)がOSの中央値の上位を占めた。オシメルチニブは一次治療に用いるEGFR TKIに比べても、アジア人患者に統計的有意性のあるOSの延長効果をもたらすわけではないので、この結果は注目に値すると著者らは強調した[20]。
GioTag試験のように、アファチニブ、オシメルチニブの順に投与を受けた後、T790M遺伝子変異による耐性を獲得した患者のOSが3年を超えるという有望な成績を残す試験が過去にあったが、UpSwinG試験の結果がそれを証明することになった[21]。ただ、同試験の対象患者の大部分は組織生検を受けて いて、主にPCR法で遺伝子変異を検出している。次世代シーケンシングとリキッドバイオプシーの実施を大幅に増やせば、分子標的治療の恩恵を受けられる患者が増えるのではないかと著者ら述べた。
高齢患者とまれな遺伝子変異
Brücklらが発表したのは、前向き非介入試験のGIDEON試験で対象になった高齢患者のデータに関する事後解析の最終成績だが、同試験はドイツの医療機関で日常的に行うアファチニブの一次治療について調べている[22]。治療を受けた患者群の43%(n=66)は70歳以上で、70歳未満の患者群と比べるとECOG PSが悪く、併存疾患のある率も高い(チャールソン併存疾患指数が1以上は70歳以上群で36%、70歳未満群で9%)傾向がみられたが、薬剤の有効性への影響はないように思われた。両群のPFSは同程度で、12か月後のPFSは70歳以上群が58.9%、70歳未満群が43.9%、OSの中央値はそれぞれ30.4か月と27.4か月だった。安全性プロファイルの内容もグレード3以上のAEの発現率も両群で差はなく、AEの発現によって減量や投与中止が必要になった率にも大差はなかった。
まれなEGFR遺伝子変異(具体的にはエクソン19欠失変異とL858R点突然変異以外)を検出したNSCLC患者への、EGFR TKIの臨床効果に関する臨床データは十分に得られていない。ランダム化比較試験や実臨床でアファチニブ投与を受けた、まれなEGFR遺伝子変異陽性NSCLC患者のデータベースに行った解析の最新成績がESMO 2021で発表された[23]。これに該当する患者は総勢1,023人にのぼり、大半の患者が臨床試験やコンパッショネート使用制度の下で治療を受けていた。
アファチニブは治療成功期間やORRの点で、まれな遺伝子変異の中でも主要なもの、複数の遺伝子変異の複合変異、E709XとL747Xのようなまれな遺伝子変異に対して著明な効果を現した。人種(アジア人患者群は11.5か月、それ以外の患者群は10.3か月、どちらもTKIの治療歴なし)と脳転移の有無(8.2か月)を問わず、治療成功期間に期待できる成績がみられた。残基A763、M766、N771、V769での特定のエクソン20挿入変異にも、そしてオシメルチニブの耐性獲得に関わるG724、 L718Q、L718V、C797Sの各変異にも有効性を示したことが解析から判明した。オシメルチニブの後にアファチニブを投与した15人のORRは36%、病勢コントロール率は100%となっていた。
TROP2を標的にした治療法
TROPION-PanTumor01試験の最新成績
ダトポタマブデルクステカン(Dato-DXd) は膜貫通型糖タンパク質のTROP2を標的に開発された抗体薬物複合体だが、TROP2は遺伝子変異の状態にか
かわらずNSCLC患者に高い確率で発 現しており、予後不良になりやすいこととも関係している[24~26]。第I相TROPION-PanTumor01試験の用量漸増期と用量拡大期で、様々ながん種を対象にDato-DXdを調査しており、NSCLCコホートにはDato-DXd4 mg/kgと6 mg/kgを各50人に、8 mg/kgを80人に投与した。
同試験のこれまでの解析では、かなりの治療歴があるこのNSCLCコホートにも有望な抗腫瘍作用があり、安全性プロファイルも治療可能な内容であることが分かっている[27、28]。WCLC 2021ではGaronらが同試験の最新成績を発表したが、それによるとDato-DXdには引き続き高い臨床効果が期待でき、3通りの用量すべてで治療可能な安全性プロファイルになっていた[29]。開発を進める用量として決まった6 mg/kgが、ORRは28%、奏効期間の中央値は10.5か月という結果を出し、経時的に効果が弱まるということがほとんどなかった。TEAEは血液毒性ではないものが主で(悪心、口内炎、脱毛症、疲労)、大半が軽度から中等度だった。薬剤関連AEと判定した間質性肺疾患が6 mg/kgコホートの6%に起きた。第Ⅲ相TROPION- Lung01試験では現在、NSCLCへのDato-DXdの臨床効果を評価している。
actionable変異のある患者へのDato-DXd使用
TROPION-PanTumor01試験で、治療薬への反応が期待できる遺伝子変異のある(AGA)患者が対象になったサブセット解析の結果が、ESMO 2021で発表された[30]。この患者群はTKIを用いた治療とプラチナ製剤ベースの化学療法が不成功に終わると、他の治療法ではあまり効果を期待できなことが知られている[31、32]。同試験のNSCLCコホートの一部であるAGAサブセットは34人で、内訳はEGFR遺伝子変異陽性(85%)、ALK融合遺伝子陽性(9%)、ROS1融合遺伝子陽性(3%)、RET融合遺伝子陽性(3%)で、このうち82%は3ライン以上の治療を受けている。
治療歴の多いこのコホートにDato-DXdの有望な抗腫瘍作用が認められた。ORRは35%、奏効期間の中央値は9.5か月となり、この試験のNSCLCコホート全体の成績と一致している[29]。EGFR遺伝子変異陽性患者群の場合、オシメルチニブに不応になった後でも臨床活性が現れた。AEはグレード1から2のものが大半で、悪心と口内炎が上位を占めたことでも安全性プロファイルが治療可能な内容であることが証明され、NSCLCコホート全体の内容とも同等だった[29]。分子標的薬と化学療法に用いるプラチナ製剤の選択肢が尽きた、actionable変異のあるNSCLC患者に対して、TROPION-Lung05試験でDato-DXdの評価をさらに進めている。
参考文献:
- Stephens P et al., Lung cancer: intragenic ERBB2 kinase mutations in tumours. Nature 2004; 431(7008): 525-526
- Mazières J et al., Lung cancer that harbors an HER2 mutation: epidemiologic characteristics and therapeutic perspectives. J Clin Oncol 2013; 31(16): 1997-2003
- Li BT et al., Primary data from DESTINY-Lung01: a phase 2 trial of trastuzumab deruxtecan in patients with HER2-mutated metastatic non-small cell lung cancer. ESMO 2021, LBA45
- Cornelissen R et al., Efficacy and safety of poziotinib in treatment-naïve NSCLC harboring HER2 exon 20 mutations: a multinational phase 2 study (ZENITH20-4). ESMO 2021, LBA46
- Jatkoe T et al., Validation of companion diagnostics for the identification of patients with EGFR exon20ins NSCLC for amivantamab therapy. WCLC 2021, P24.14
- Leighl N et al., Amivantamab monotherapy and in combination with lazertinib in post-osimertinib EGFR-mutant NSCLC: analysis from the CHRYSALIS study. ESMO 2021, 1192M0
- Spira AI et al., Amivantamab in non-small cell lung cancer with MET exon 14 skipping mutation: initial results from CHRYSALIS. WCLC 2021, OA15.03
- Frampton GM et al., Activation of MET via diverse exon 14 splicing alterations occurs in multiple tumor types and confers clinical sensitivity to MET inhibitors. Cancer Discov 2015; 5(8): 850-859
- Camidge DR et al., Telisotuzumab vedotin monotherapy in patients with previously treated c-Met+ advanced non-small cell lung cancer. WCLC, OA 15.04
- Riely GR et al., Activity and safety of mobocertinib (TAK-788) in previously treated non-small cell lung cancer with EGFR exon 20 insertion mutations from a phase I/II trial. Cancer Discov 2021; 11(7): 1688-1699
- Spira AI et al., Mobocertinib in EGFR exon 20 insertion-positive metastatic NSCLC patients with disease control on prior EGFR TKI therapy. ESMO 2021, OA15.01
- Jänne P et al., Phase 1 studies of DZD9008, an oral, selective EGFR/HER2 inhibitor in advanced NSCLC with EGFR exon20 insertion mutation. WCLC 2021, OA15.02
- Seto T et al., Erlotinib alone or with bevacizumab as first-line therapy in patients with advanced non-squamous non-small-cell lung cancer harbouring EGFR mutations (JO25567): an open-label, randomised, multicentre, phase 2 study. Lancet Oncol 2014; 15(11): 1236-1244
- Saito H et al., Erlotinib plus bevacizumab versus erlotinib alone in patients with EGFR-positive advanced non-squamous non-small-cell lung cancer (NEJ026): interim analysis of an open-label, randomised, multicentre, phase 3 trial. Lancet Oncol 2019; 20(5): 625-635
- Nakagawa K et al., Ramucirumab plus erlotinib in patients with untreated, EGFR-mutated, advanced non-small-cell lung cancer (RELAY): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2019; 20(12): 1655-1669
- Piccirillo MC et al., Bevacizumab + erlotinib vs erlotinib alone as first-line treatment of patients with EGFR mutated advanced non squamous NSCLC. Final analysis of the multicenter, randomized, phase III BEVERLY trial. ESMO 2021, 12070
- Kenmotsu H et al., Primary results of a randomized phase II study of osimertinib plus bevacizumab versus osimertinib monotherapy for untreated patients with non-squamous non-small-cell lung cancer harboring EGFR mutations; WJOG9717L study. ESMO 2021, LBA44
- Girard N et al., Optimizing outcomes and treatment sequences in EGFR mutation-positive non-small-cell lung cancer: recent updates. Future Oncol 2019; 15(25): 2983-2997
- Popat S et al., Sequential afatinib and osimertinib in patients with advanced EGFRm+ NSCLC and acquired T790M: the real-world UpSwinG study. WCLC 2021, P51.05
- Kim ES et al., EGFR tyrosine kinase inhibitors for EGFR mutation-positive non-small-cell lung cancer: outcomes in Asian populations. Future Oncol 2021; 17(18): 2395-2408
- Hochmair MJ et al., Sequential afatinib and osimertinib in patients with EGFR mutation-positive non-small-cell lung cancer: final analysis of the GioTag study. Future Oncol 2020; 16(34): 2799-2808
- Brueckl WM et al., Elderly patients treated with afatinib in clinical practice – final results of the GIDEON study in EGFR mutated NSCLC in Germany. ESMO 2021, 1230P
- Yang JCH et al., Afatinib for the treatment of NSCLC with uncommon EGFR mutations: an updated database of 1023 cases. ESMO 2021, 1212P
- Mito R et al., Clinical impact of TROP2 in non-small lung cancers and its correlation with abnormal p53 nuclear accumulation. Pathol Int 2020; 70(5): 287-294
- Inamura K et al., Association of tumor TROP2 expression with prognosis varies among lung cancer subtypes. Oncotarget 2017; 8(17): 28725-28735
- Jiang A et al., Expression and clinical significance of the Trop-2 gene in advanced non-small cell lung carcinoma. Oncol Lett 2013; 6(2): 375-380
- Meric-Bernstam F et al., TROPION-PanTumor 01: dose analysis of the TROP2-directed antibody-drug conjugate datopotamab deruxtecan for the treatment of advanced or metastatic non-small cell lung cancer. J Clin Oncol 39, 2021 (suppl 15; abstr 9058)
- Spira A et al., Datopotamab deruxtecan (Dato-DXd; DS-1062), a TROP2 ADC, in patients with advanced NSCLC: updated results of TROPION-PanTumor01 phase 1 study. WCLC 2020, OA03.03
- Garon EB et al., TROPION-PanTumor01: updated results from the NSCLC cohort of the phase 1 study of datopotamab deruxtecan in solid tumors. WCLC 2021, MA03.02
- Garon EB et al., Efficacy of datopotamab deruxtecan in patients with advanced/metastatic non-small cell lung cancer and actionable genomic alterations: preliminary results from the phase 1 TROPION-PanTumor01 study. ESMO 2021, LBA49
- Scagliotti GV et al., Addressing the unmet need in lung cancer: The potential of immuno-oncology. Cancer Treat Rev 2015; 41(6): 465-475
- Maione P et al., Overcoming resistance to targeted therapies in NSCLC: current approaches and clinical application. Ther Adv Med Oncol 2015; 7(5): 263-273
© 2021 Springer-Verlag GmbH, Impressum