I期からⅢ期の肺がんへの治療法と新たな知見の増加
ステージI期からⅢ期の非小細胞肺がん(NSCLC)は治癒を目指して治療しても60%近くの患者が再発するため、アンメットニーズの高さがいまだ特徴になっている[1]。IMpower010試験は、完全切除とプラチナ製剤ベースの化学療法の実施後に行った免疫アジュバント療法が、無病生存期間(DFS)に延長効果をもたらした初の第Ⅲ相試験である。DFSに関する中間解析の結果によると、PD-L1が陽性(TCの1%以上に陽性反応あり)のⅡ期からⅢA期の患者集団と、ランダム割り付けしたⅡ期からⅢA期の全患者集団では、ベストサポーティブケア(BSC)に比べてアテゾリズマブ1,200 mgを3週間おきに投与した群にDFSの延長効果がみられた(HRはPD-L1陽性群が0.66、ランダム割り付けした全群が0.79)[2]。ITT解析対象集団(ランダム割り付けしたIB期~ⅢA期の全患者)の場合、DFSが統計学的有意性のある境界を越えることはなかった。
DFSを中間解析した時点で認められた再発部位と再発がんの治療について、FelipらがESMO 2021で報告した[3]。なお、ランダム割り付けしたⅡ期からⅢA期の全患者集団のDFSをPD-L1の発現率ごとに調べているが、アテゾリズマブを投与されたTC50%以上の患者群でリスク減少率が最大(HR:0.43)になっていたのに対して、TC1~49%の患者群に統計学的有意な減少(HR:0.87)はみられなかった。
IMpower010試験で一貫したベネフィットを認める
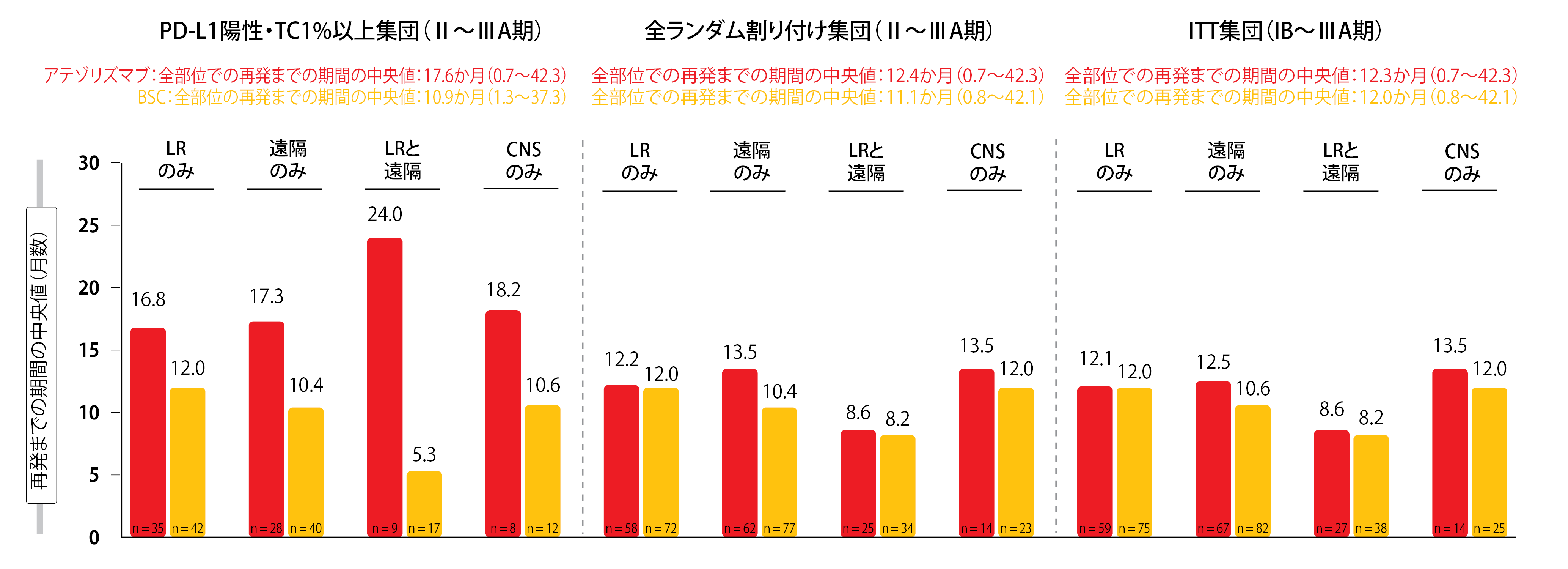
全集団を通じて同じような再発のパターンがみられた。Ⅱ期からⅢA期のPD-L1陽性集団では、局所・領域再発のみが両治療群に多く認められたのに対して(アテゾリズマブ群では47.9%、BSC群では41.2%)、遠隔転移再発のみというのはあまり認められなかった(同38.4%、同39.2%)。一方、ランダム割り付けしたⅡ期からⅢA期の全患者集団とIB期からⅢA期のITT解析対象集団の場合、どちらの治療を受けているかにかかわらず、局所・領域再発よりも遠隔転移再発が若干多くなっていた。中枢神経系での再発だけがみられたのは、全集団を通じてアテゾリズマブ群が9.0%、BSC群が12.3%だった。Ⅱ期からⅢA期のPD-L1陽性集団では、どの再発部位でもアテゾリズマブ群でランダム割り付けから再発までの期間が延長していたが、ランダム割り付けしたⅡ期からⅢA期の全患者集団そしてIB期からⅢA期のITT解析対象集団の場合、両治療群の間であまり差はなかった(図1)。
再発後の治療については、3集団のアテゾリズマブ群に比べてBSC群で免疫療法の実施率が高くなったことが中間解析結果から判明したが、化学療法や分子標的薬といった他の治療法に差異はみられなかった。また、手術と放射線治療でも同様の傾向がみられた。追跡期間をより長くとることが必要で、そうすれば再発部位や治療法の間で差が明らかになるだろうと、著者らは締めくくった。
手術の術式など再発前に受けていた治療法およびDFSへのその影響について、同試験の一環で行う探索的データ解析で評価している[4]。ランダム割り付けしたITT解析対象集団(n=1,005)の場合、大半の患者が肺葉切除術(78.1%)やリンパ節郭清術(80.7%)を受けており、大部分の患者がアジュバント化学療法を4コース受けていた。手術後からアテゾリズマブの初回投与またはBSCの1回目までの期間の中央値はほぼ同じだった(アテゾリズマブは5.2か月、BSCは5.1か月)。Ⅱ期からⅢA期のTC1%以上のPD-L1陽性患者集団とランダム割り付けしたⅡ期からⅢA期の全患者集団の場合、ほぼすべてのステージ、リンパ節に再発した患者、ほぼすべての術式と化学療法レジメンで、BSC群よりもアジュバント療法のアテゾリズマブ群でDFSが延長したことがフォレストプロットから見て取れた。
図1:IMpower010試験で対象になったPD-L1陽性でTCが1%以上のⅡ期からⅢA期の患者集団、ランダム割り付けしたⅡ期からⅢA期の全患者集団、IB期からⅢA期のITT解析対象集団のランダム割り付けから再発までの期間 LR:局所・領域、CNS:中枢神経系
NADIM試験:ニボルマブを用いたネオアジュバント化学療法
第Ⅱ相単群NADIM試験では、ⅢA期N2またはT4 N0またはN1の切除可能な腫瘍のある患者を対象に、パクリタキセルおよびカルボプラチンのネオアジュバント化学療法3コースにニボルマブ360 mgの3週間間隔投与を加えた療法を評価している。3コース目の最終日(21日目)から3、4週間後に手術を行い、アジュバント療法にはニボルマブを単独で1年間投与した。主要評価項目である24か月後の無増悪生存率(PFS)は一時解析によると77.1%となり、プラチナ製剤ベースの化学療法にニボルマブをネオアジュバント療法として追加する妥当性を示した[5]。
WCLC 2021では、ITT解析対象集団(n=46)および治験実施計画書に適合した対象集団(PPS:n=37)の3年全生存率(OS)に関する解析報告があった[6]。なお、PPSにはアジュバント化学療法を受けた患者群が含まれている。同試験では3年生存率がITT解析集団で81.9%、PPSで91.0%と、生存に関して期待できる成績が示された。この数十年間、およそ30%にとどまっていた3年生存率をはるかに上回る結果がみられ、42か月目の生存率はITT解析対象集団が78.9%、PPSが87.3%、PFSはそれぞれ69.6%と81.1%にのぼった。
奏効状態に関係するパラメーターの予測因子として役立つかを明確にするため、探索的データ解析を行った。CT所見に基づいた臨床的奏効では生存転帰の予測ができなかったのに対して、病理学的完全奏効と血中循環腫瘍DNAクリアランス(ネオアジュバント療法後のctDNAの検出不能)は長期生存の予測に非常に役立っていた。
ネオアジュバント化学療法にニボルマブを追加しても安全性プロファイルに悪影響を及ぼすことはなく、アジュバント化学療法とネオアジュバント化学療法のどちらでも、実施期間中に現れた治療関連有害事象(TRAE)は大半がグレード1もしくは2で、命に関わるものは発現しなかった。
PACIFICリアルワールド観察研究
切除不能なⅢ期のNSCLC患者で、同時化学放射線療法(CRT)を受けた後に病勢進行した患者にはデュルバルマブによる地固め療法が標準治療になりうることが、PACIFIC試験の第Ⅲ相試験で定まった。同試験ではOS、PFSへの延長効果が安定して長期間続き、5年間の追跡調査後でも3分の1の患者に増悪がみられなかった[7]。現在、複数の国で行われているPACIFIC-Rリアルワールド観察研究で、PACIFIC試験のレジメンの有効性を実臨床下で調査している。ESMO 2021で発表のあった解析の対象者は切除不能なⅢ期のNSCLC患者の合計1,399人で、PD-L1の発現状況を問わず、11か国の医療機関290施設で早期アクセスプログラムに組み入れられた患者である[8]。
治療期間の中央値の約11か月後に確認したデュルバルマブ群のPFSについては、リアルワールド観察研究で認められた中央値がPACIFIC試験のそれを上回った(観察研究では21.7か月、PACIFIC試験では16.9か月)。リアルワールド観察研究のデータ収集が適切にできなかったことで、比較に支障を来したと著者らは指摘している。RECISTの用い方が国によって異なったり、病勢進行の評価が新型コロナウイルス感染症の影響できちんと行えなかった可能性があったりする点などが、その理由である。こういった問題があったにも関わらず、解析対象になったサブグループにCRTを行った後のデュルバルマブ投与の効果については、PACIFIC試験で得たデータとほぼ一致していた[9]。リアルワールド観察研究でのデュルバルマブを用いた地固め療法に関しては、ⅢA期のPFSの方がⅢB期・ⅢC期のPFSよりも長くなっており(ⅢA期群は23.7か月、ⅢB期・ⅢC期群は19.2か月)、PD-L1陽性群と同陰性群(22.4か月、16.3か月)、同時化学放射線療法群と逐次化学放射線療法群(23.7か月、19.4か月)、非扁平上皮がん群と扁平上皮がん群(25.3か月、14.7か月)では、それぞれ前者のPFSが長くなっていた。
休薬(5.2%)および投与中止(9.5%)の場合、原因になったAEは間質性肺炎(間質性肺疾患)が最も多く、患者の18%に間質性肺炎が発症したが軽度または中等度が大半を占め、71.3%にステロイド剤の投与が必要になった。AEによる投与中止率(16.7%)および病勢進行よる投与中止率(26.9%)はPACIFIC試験での率(15.4%と31.3%)と一致していた[7]。CRT後に約11か月間行ったデュルバルマブによる地固め療法がおおむね有効だったことが、大規模リアルワールド観察研究のコホートから証明された。
デュルバルマブと新薬の併用療法
患者転帰をさらに改善させることを目的に、デュルバルマブとそれ以外の免疫調節薬を併用する地固め療法の有効性をPACIFIC試験と同じ設定で調査している。第Ⅱ相国際共同オープンラベルランダム化比較COAST試験では、デュルバルマブ単独療法と、デュルバルマブと抗CD73抗体のオレクルマブまたは抗NKG2A抗体のモナリズマブとの併用療法を比較検討した。放射線治療の実施が、抗腫瘍免疫応答を抑制するCD73とNKG2AのリガンドであるHLA-Eの発現を招く[10~12]。免疫チェックポイント阻害薬を併用するかどうかは問わず、放射線治療に抗CD73抗体と抗NKG2A抗体を併用すると抗腫瘍作用が増強することが前臨床モデルで示されている[10、11]。
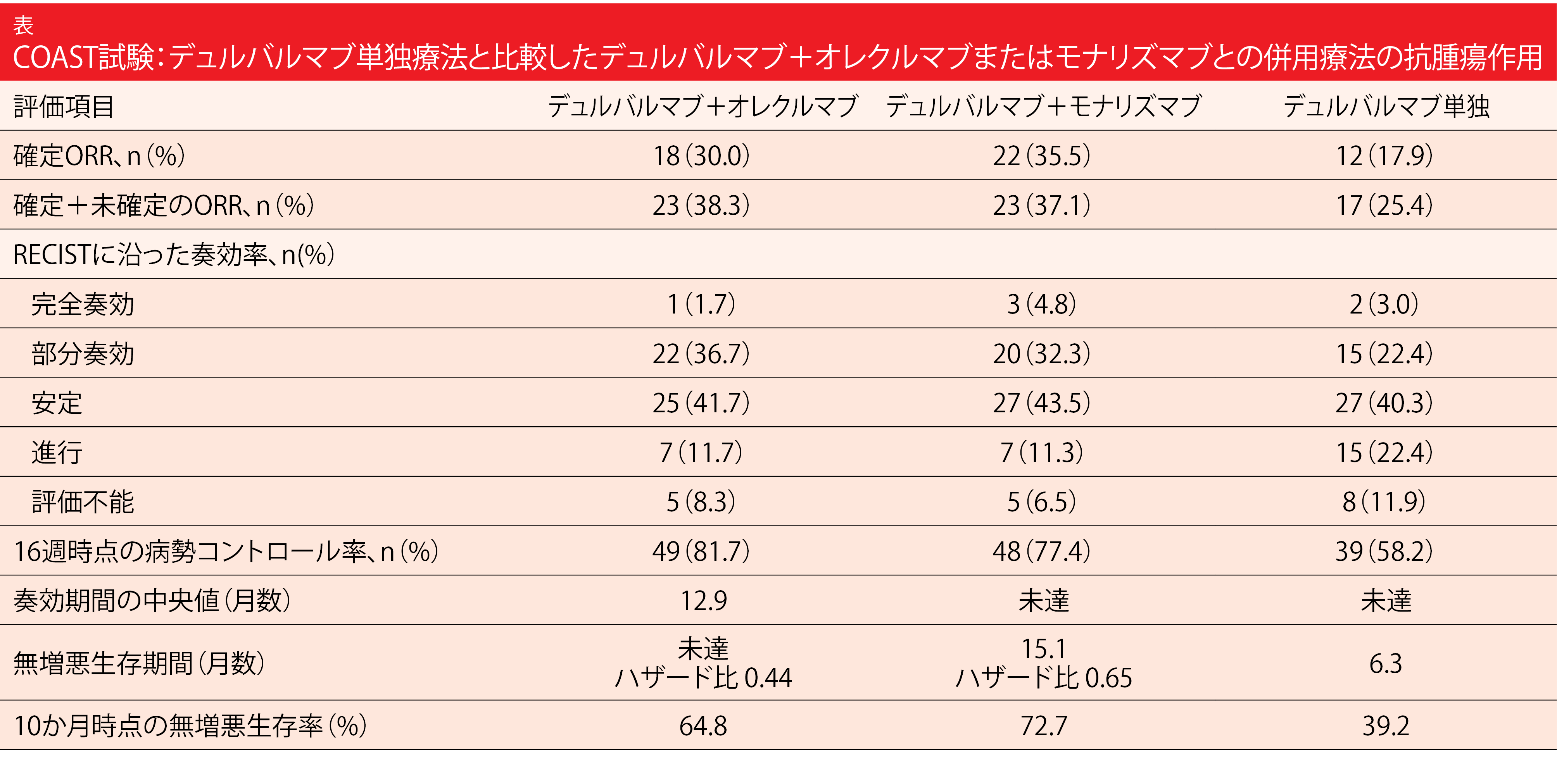
9か国の82施設で3群を対象に行うCOAST試験では、デュルバルマブ1,500 mgとオレクルマブ3,000 mgの4週間間隔併用投与群(n=60)を、デュルバルマブ1,500 mgの4週間間隔投与とモナリズマブ750 mgの隔週併用投与群(n=62)およびデュルバルマブ1,500 mgの4週間間隔単独投与群(n=67)と比較した。主要評価項目は奏効率(ORR)とした。ESMO 2021で発表した中間解析のデータによると、オレクルマブもモナリズマブもデュルバルマブと併用することで臨床的有用性が高まっていた[13]。どちらの併用投与群でもデュルバルマブ単独投与群に比べてORRの数値が上昇しており、PFSに統計学的有意性のある延長効果がみられた(表)。両薬剤の併用投与がPFSの延長をもたらしたことは複数のサブグループで認められている。
安全性プロファイルはすべての群で同様で、間質性肺炎といった特に注目すべきAEの発現率も変わりはなく、どちらの併用投与群でも安全性の問題は新たに浮上していない。COAST試験は第Ⅱ相ランダム化比較試験としては、PACIFIC試験と同様の設定で、免疫調節薬の新薬の併用により転帰改善のエビデンスが初めて認められた試験である。今回得たデータが、治験で両剤の併用投与をより詳しく評価する際の裏付けになるだろう。
GEMSTONE-301試験:スゲマリマブ
PACIFIC試験と同様に地固め療法を調査したもう一つの試験が、第Ⅲ相二重盲検プラセボ対照ランダム化比較試験のGEMSTONE-301試験である。切除不能なⅢ期のNSCLCの中国人患者で、同時化学放射線療法後もしくは逐次化学放射線療法後に進行しなかった患者を対象に、最長で24か月間にわたって抗PD-L1抗体のスゲマリマブ1,200 mgを3週間おきに投与する群(n=255)を、プラセボ群(n=126)と比較した。同時化学放射線療法を受けられる医療機関がなく、毒性の強さも見受けられることから、同試験は、この設定で同時化学放射線療法後や逐次化学放射線療法後の抗PD-L1抗体薬の有効性を評価する初の第Ⅲ相試験となった。患者の併存疾患や治療を受けられる施設のないことが、実臨床で同時化学放射線療法をほとんど行えない理由になっている。同試験の対象患者の3分の2が同時化学放射線療法を、3分の1が逐次化学放射線療法を受けた。
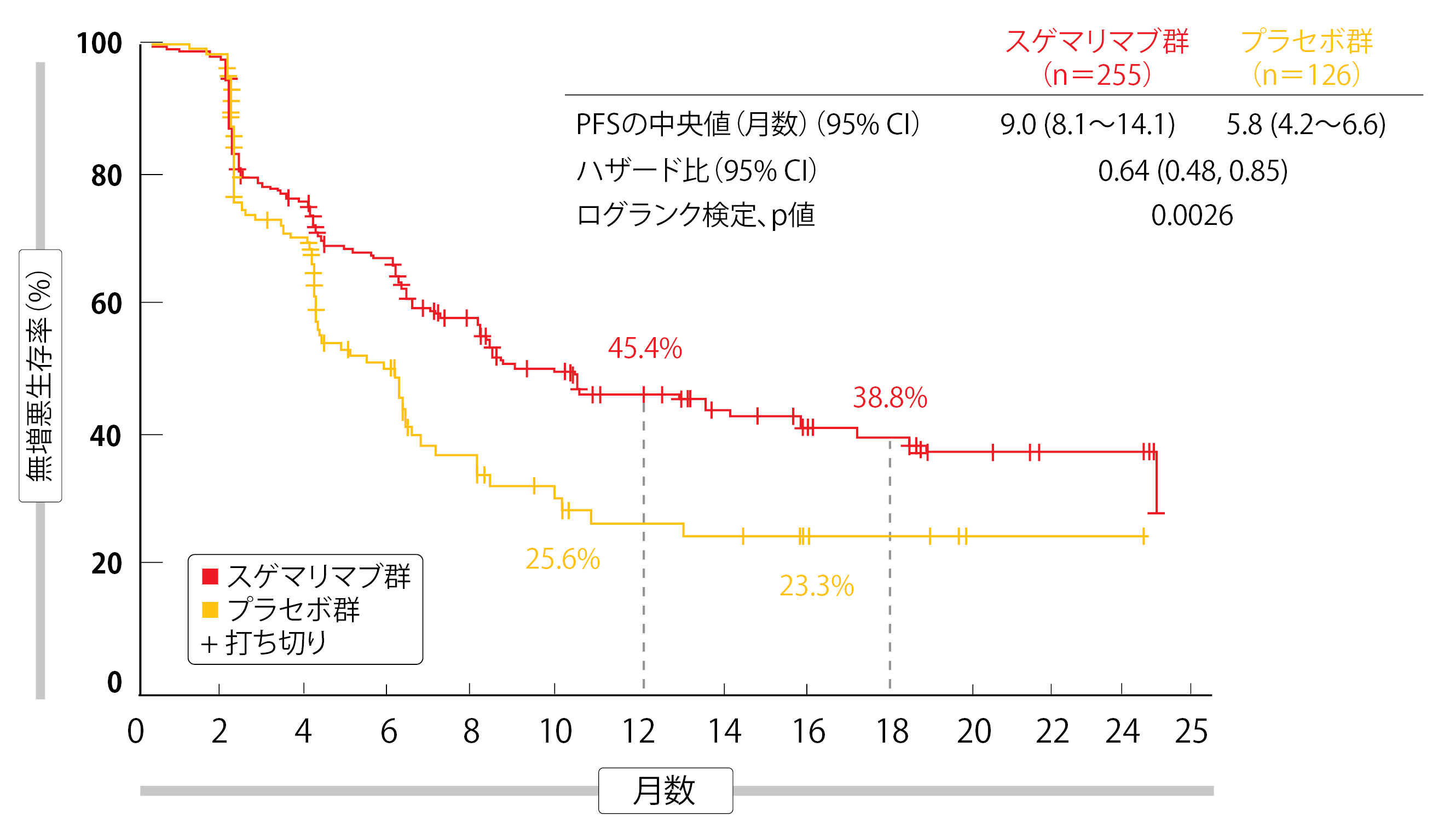
盲検化した独立審査委員会が判定したORRを主要評価項目とした。Wuらが規定に沿って行った中間解析の結果をESMO 2021で報告したが、それによると統計学的有意性があり臨床的意義のあるPFSの延長効果がスゲマリマブ群にみられた(スゲマリマブ群9.0か月、プラセボ群5.8か月、HR:0.64、p=0.0026、図2)[14]。同時化学放射線療法を受けた場合のPFSは前者が10.5か月、後者が6.4か月(HR:0.66)、逐次化学放射線療法を受けた場合はそれぞれ8.1か月と4.1か月(HR:0.59)になった。中間解析の時点ではOSのデータがまだ判明していなかったが、プラセボ群よりもスゲマリマブ群での改善効果がはっきりとしており(全患者のうちスゲマリマブ群は未達、プラセボ群は24.1か月、HR:0.44)、24か月後に生存していた患者の割合はスゲマリマブ群で非常に大きくなっていた(同78.0%、同50.7%)。
今回、スゲマリマブ群にみられた安全性プロファイルは良好で、以前にNSCLC患者に行ったスゲマリマブ単独療法に関して報告のあった内容と一致していた。免疫関連AEがスゲマリマブ群の42.7%に発現し、そのうちの4.7%がグレード3~5に分類された。試験薬投与後に発現したAEにより治療コースの開始を遅らせたのは32.2%、投与中止に至ったのは11.4%である。切除不能なⅢ期のNSCLC患者への同時化学放射線療法後あるいは逐次化学放射線療法後に、スゲマリマブを用いた地固め療法を行うことの有効性が同試験で示唆されたとの要約を、著者が述べた。
図2:切除不能なⅢ期NSCLC患者への同時化学放射線療法後または逐次化学放射線療法後の、無増悪生存率に関するスゲマリマブ群とプラセボ群との比較
LungART試験の補足的な評価
(ネオ)アジュバント化学療法を受け、NSCLCおよびN2のリンパ節転移を完全に切除した患者252人に、線量54 Gyの術後原体照射療法(PORT)を5.5週間にわたって行った結果を、第Ⅲ相ランダム化比較LungART試験で評価した。主要評価項目はDFSである。昨年発表のあった一時解析結果によると、PORTを行った群のDFSは行わなかった群(n=249)のそれよりわずかに延びており(前者は30.5か月、後者は22.8か月、HR:0.86、p=0.18)、3年後のDFSはそれぞれ47.1%と43.8%になっていた[15]。3年生存率はそれぞれ66.5%と68.5%だった。PORTは縦隔再発のリスクを低下させたが遠隔転移にはそうならず、脳転移のリスクも低下させられないようだった。Le Pechouxらが最近行った解析では、同試験でみられた失敗のパターンそしてPORTの有効性に関わる予測因子を調べている[16]。
この解析結果によると、縦隔再発が生じたのは初めに転移したリンパ節がほとんどだった。縦隔リンパ節の再発が特に多く生じた3つのステーションは、右肺が4R、2R、7、左肺は7、4L、4Rだった。DFSの予測因子については女性・扁平上皮がん・リンパ節転移なしが良好さの予測因子となっていた。年齢とWHOのパフォーマンスステータス以外では、リンパ節転移の個数やリンパ節郭清を十分に行ったかが、DFSに関係していた。縦隔での再発がない場合の3年生存率は、リンパ節転移の個数と被膜外浸潤の有無にかかわらず、PORT実施群で統計学的有意に改善していた。どの患者にPORTを行うかは、再発の予測
因子および毒性と有効性の評価に基づいて決めるべきだと、著者らは締めくくった。n
参考文献:
- Vansteenkiste J et al., Current status of immune checkpoint inhibition in early-stage NSCLC. Ann Oncol 2019; 30(8): 1244-1253
- Wakelee H et al., IMpower010: Primary results of a phase III global study of atezolizumab versus best supportive care after adjuvant chemotherapy in resected stage IB-IIIA non-small cell lung cancer (NSCLC). J Clin Oncol 2021; 39(suppl 15): 8500#
- Felip E et al., IMPower010: sites of relapse and subsequent therapy from a phase 3 study of atezolizumab vs best supportive care after adjuvant chemotherapy in resected stage IB-IIIA NSCLC. ESMO 2021, LBA9
- Altorki N et al., IMpower010: characterization of stage IB-IIIA NSCLC patients by type and extent of therapy prior to adjuvant atezolizumab. WCLC 2021, PL02.05
- Provencio M et al., Neoadjuvant chemotherapy and nivolumab in resectable non-small-cell lung cancer (NADIM): an open-label, multicentre, single-arm, phase 2 trial. Lancet Oncol 2020; 21(11): 1413-1422
- Provencio M et al., Long term survival in operable stage IIIA NSCLC patients treated with neoadjuvant nivolumab plus chemotherapy – NADIM study. WCLC 2021, OA20.01
- Spigel DR et al., Five-year survival outcomes with durvalumab after chemoradiotherapy in unresectable stage III NSCLC: An update from the PACIFIC trial. J Clin Oncol 39, 2021 (suppl 15; abstr 8511)
- Girard N et al., PACIFIC-R real-world study: treatment duration and interim analysis of progression-free survival in unresectable stage III NSCLC patients treated with durvalumab after chemoradiotherapy. ESMO 2021, 1171M0
- Antonia SJ et al., Durvalumab after chemoradiotherapy in stage III non-small-cell lung cancer. N Engl J Med 2017; 377(20): 1919-1929
- Wennerberg E et al., CD73 blockade promotes dendritic cell infiltration of irradiated tumors and tumor rejection. Cancer Immunol Res 2020; 8(4): 465-478
- Tsukui H et al., CD73 blockade enhances the local and abscopal effects of radiotherapy in a murine rectal cancer model. BMC Cancer 2020; 20(1): 411
- Nguyen AM et al., Upregulation of CD73 confers acquired radioresistance and is required for maintaining irradiation-selected pancreatic cancer cells in a mesenchymal state. Mol Cell Proteomics 2020; 19(2): 375-389
- Martinez-Marti A et al., COAST: an open-label, phase 2, multidrug platform study of durvalumab alone or in combination with novel agents in patients with locally advanced, unresectable, stage III NSCLC. ESMO 2021, LBA42
- W Y-L et al., GEMSTONE-301: a randomized, double-blind, placebo-controlled, phase 3 study of sugemalimab in patients with unresectable stage III non-small cell lung cancer without progression after concurrent or sequential chemoradiotherapy. ESMO 2021, LBA43
- Le Pechoux C et al., An international randomized trial comparing post-operative radiotherapy (PORT) to no PORT, in patients with completely resected NSCLC and mediastinal N2 involvement. ESMO 2020, LBA3_PR
- Le Pechoux C et al., An international randomized trial comparing post-operative conformal radiotherapy (PORT) to no PORT in patients with completely resected non-small cell lung cancer and mediastinal N2 involvement. ESMO 2021, 11700
© 2021 Springer-Verlag GmbH, Impressum
More posts
ATALANTE-1試験:がん免疫療法が不成功に終わった後の抗がんワクチン使用
ATALANTE-1試験:がん免疫療法が不成功に終わった後の抗がんワクチン使用 OSE-2101は、HLA-A2+拘束性修飾ネオエピトープを利用した抗がんワク
徐々に進展する中皮腫および胸腺腫の 治療管理法
徐々に進展する中皮腫および胸腺腫の 治療管理法 Oliver Gautschi, MD, Luzerner Kantonsspital, Lucerne, Sw
悪性胸膜中皮腫:全治療ラインで行う免疫チェックポイント阻害薬をベースにした治療法
悪性胸膜中皮腫:全治療ラインで行う免疫チェックポイント阻害薬をベースにした治療法 CheckMate 743試験の長期成績 第Ⅲ相ランダム化比較CheckMa
小細胞肺がん:有効性と忍容性改善への道のり
小細胞肺がん:有効性と忍容性改善への道のり ATLANTIS試験 プラチナ製剤ベースの化学療法の実施中やその後に病勢が進行した小細胞肺がん(SCLC)患者には
免疫チェックポイント阻害療法:効果の増大および耐性の克服
免疫チェックポイント阻害療法:効果の増大および耐性の克服 POSEIDON試験:デュルバルマブ併用療法へのトレメリムマブの追加 第Ⅲ相国際共同オープンラベルラ
多岐にわたる遺伝子変異をターゲットにする新規治療薬や既存の治療薬
多岐にわたる遺伝子変異をターゲットにする新規治療薬や既存の治療薬 抗HER2療法 DESTINY-Lung01試験:T-DXdの確固たる効果 HER2変異は非