Biopsia líquida en el contexto de mutaciones en EGFR y de otro tipo
En comparación con la biopsia tisular y la biopsia repetida, la biopsia líquida ofrece varias ventajas, como mínima invasividad, oportunidad de realizar determinaciones seriadas a lo largo del tiempo para vigilar la respuesta tumoral y detección de mutaciones de resistencia en el plasma antes de la detección radiológica [1]. También se tiene en cuenta la cuestión de la heterogeneidad tumoral, que es un factor importante en el fracaso del tratamiento. Pueden identificarse mutaciones iniciadoras con una sensibilidad y especificidad elevadas, lo que mejora la prestación de una medicina personalizada. Aunque sigue habiendo aspectos controvertidos, como normalización, validación de diferentes tecnologías y concordancia con los resultados de perfiles moleculares tisulares, la biopsia líquida ha surgido como herramienta alternativa para controlar a los pacientes con CPNM avanzado.
Tasa elevada de concordancia entre plasma y tejido
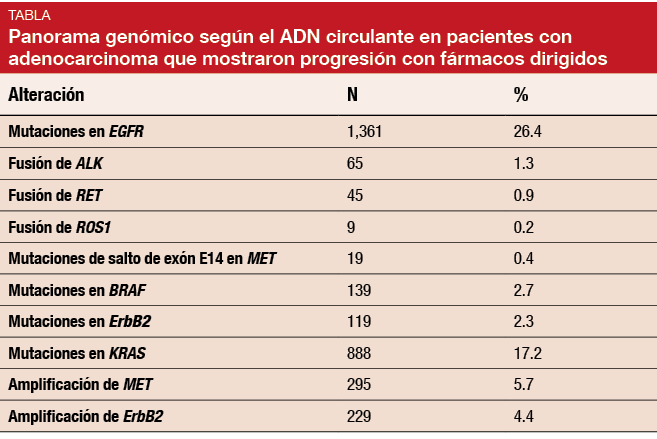
Uno de los diversos análisis presentados en la WCLC que confirmaron que la biopsia líquida es una técnica de referencia emergente fue el de Mack y cols., en el que se evaluó el análisis Guardant360 en cuanto a genómica a escala poblacional (en comparación con el Cancer Genome Atlas), exactitud clínica y utilidad clínica [2]. El análisis Guardant360 posibilita la secuenciación digital de exones críticos de 73 genes basándose en ADN tumoral circulante (ADNtc). La cohorte estuvo formada por 8388 pacientes con adenocarcinoma en estadio III/IV (n = 4142) o CPNM sin especificar (n = 4246), con obtención de 9202 muestras. Entre el diagnóstico inicial y la obtención del ADNtc había transcurrido una mediana de 177 días. Se dispuso de información tisular de un subgrupo de pacientes. Hay que señalar que no se trató de una muestra representativa aleatoria de pacientes, ya que el análisis se vio enriquecido con pacientes que mostraron progresión con fármacos dirigidos. Por lo general, estos estaban recibiendo tratamiento de segunda línea o posterior.
La tasa global de detección de alteraciones fue del 87%, con una mediana de tres alteraciones por muestra (intervalo, 0-93). Las mutaciones detectadas en el plasma mostraron una frecuencia y una distribución similares a las descritas en el tejido, lo que se aplicó a mutaciones troncales presentes en todas las líneas del tumor. Los patrones de fusión de ADNtc fueron un reflejo del tejido tumoral, según el análisis Guardant360. En los pacientes con adenocarcinoma, se identificaron mutaciones en EGFR en el 26,4% de los casos (Tabla). Las deleciones en el exón 19 constituyeron la mayoría de las mutaciones iniciadoras de EGFR (52%), seguidas de las mutaciones L858R (34%) y las inserciones en el exón 20 (4%).
Como ya se sabe, las mutaciones iniciadoras fueron mutuamente excluyentes en un grado estadísticamente muy significativo. Por ejemplo, cuando hubo presencia de una mutación en EGFR, no hubo mutación en KRAS y viceversa. Los casos de solapamiento podrían deberse a la aparición de mutaciones de resistencia secundarias.
Aumento del rendimiento de biomarcadores del 65%
La exactitud clínica se determinó en un subgrupo de 543 pacientes con marcadores positivos de los que se dispuso de información tisular. En este caso, los valores predictivos positivos oscilaron entre el 92% y 100% según el tipo de mutación. Todos los pacientes con muestras de plasma positivas para mutaciones en KRAS, BRAFV600E y de salto de exón E14 en MET también tuvieron estas mutaciones en el tejido tumoral. En lo que respecta a las fusiones de ALK, RET y ROS1, el 92% no mostró resultados tisulares positivos; se trató muy probablemente de falsos negativos. El 40% de los casos de fusión de ALK y el 50% de aquellos con EGFR positivo tuvieron una diana de resistencia potencialmente susceptible de actuación en el momento de progresión. En general, el análisis de plasma confirió un beneficio adicional, ya que la secuenciación de última generación de ADNtc aumentó el rendimiento de biomarcadores en un 65%. Esto se correspondió con otros 252 biomarcadores susceptibles de actuación. Se detectaron mutaciones oncoiniciadoras en el 29% de los casos de tejido infragenotipificado o no evaluable.
Santos y cols. también emplearon el análisis Guardant360 para realizar una evaluación por biopsia líquida de 100 pacientes consecutivos con adenocarcinoma en estadio IV o recurrente [3]. Se obtuvieron o recuperaron resultados de perfiles moleculares tisulares de cada sujeto para fines de comparación con sus contrapartidas de biopsia líquida. Los investigadores constataron que la concordancia entre las dos metodologías con respecto al tipo de alteración fue máxima con las mutaciones en EGFR (68%). Esto sucedió así aun cuando el análisis de ADN circulante se hubiera realizado meses o incluso años después del análisis de tejido tumoral. Ninguna de las biopsias líquidas se practicó en el momento del diagnóstico o la biopsia tumoral.
La tasa de identificación de anomalías fue mayor con la biopsia líquida que con el análisis tisular. El 46% de los pacientes con anomalías de EGFR según la biopsia líquida presentó mutaciones susceptibles de actuación. Dieciséis de los 35 pacientes con alteraciones de EGFR mostraron mutaciones o variantes identificadas únicamente mediante biopsia líquida; en 5 de estos 16 casos se identificaron mutaciones en EGFR susceptibles de actuación exclusivamente mediante el uso de biopsia líquida.
Detección de la mutación T790M
En el ensayo de fase I/II TIGER-X se realizó un análisis combinado de mutaciones en EGFR en orina y plasma [4]. En dicho estudio participaron 548 pacientes con mutaciones activadoras de EGFR que ya habían sido tratados con ITC dirigidos contra el EGFR. Recibieron el ITC del EGFR rociletinib, que ya no se encuentra en fase de desarrollo clínico. En este ensayo se enviaron 540 muestras de tejido, 482 de plasma y 213 de orina para el análisis de EGFR previo al tratamiento. El análisis contó con 174 muestras de tejido, plasma y orina emparejadas.
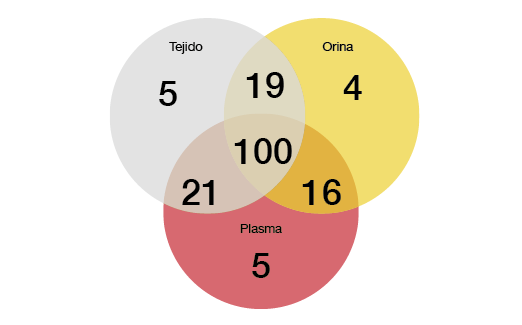
Se comprobó que la detección no invasiva de T790M en orina y plasma fue muy sensible. En relación con los análisis realizados en plasma y orina, la sensibilidad superó el 80%. Se obtuvieron tasas aún mayores con el análisis combinado, cuya sensibilidad alcanzó el 96,6%, En lo que respecta a las 174 muestras de tejido, plasma y orina emparejadas, la positividad de T790M en cualquier tipo de muestra fue del 97,7%. El análisis combinado de plasma y orina identificó más casos con T790M positiva que el análisis tisular aislado (Figura). Las tasas de respuesta observadas con el rociletinib fueron similares con independencia de que las mutaciones T790M se detectaran mediante biopsia líquida o tisular.
Figura: Aumento de la detección de T790M con el uso combinado del análisis de plasma y orina (170 casos con T790M positiva)
Además, los análisis revelaron que las mutaciones T790M se detectaron más fácilmente en el plasma de pacientes con lesiones extratorácicas (M1b) que en aquellos que solo presentaban afectación intratorácica (M1a/M0). Sin embargo, el análisis combinado de plasma y orina posibilitó una detección sensible con independencia del estado de la enfermedad. La sensibilidad fue del 90,7% y 95,8% en los pacientes con enfermedad M1a/M0 y M1b, respectivamente. Los autores llegaron a la conclusión de que el análisis combinado de plasma y orina debe contemplarse antes que el tisular en los pacientes con CPNM resistente a ITC de EGFR, incluidos aquellos con metástasis extratorácicas.
BIBLIOGRAFÍA
- Burrell RA & Swanton C, Tumour heterogeneity and the evolution of polyclonal drug resistance. Mol Oncol 2014; 8(6): 1095-1111
- Mack PC et al., Clinical utility of circulating tumor DNA (ctDNA) analysis by digital next generation sequencing of over 5,000 advanced NSCLC patients. WCLC 2016, OA06.01
- Santos ES et al., Report on liquid biopsies from advanced lung adenocarcinoma patients and correlation with their tumor biopsy profiles. WCLC 2016, OA10.07
- Wakelee HA et al., A highly sensitive next-generation sequencing platform for detection of NSCLC EGFR T790M mutation in urine and plasma. WCLC 2016, MA08.01