Tratamientos emergentes en el CPNM con ALK positivo: nuevas opciones, pero también nuevos desafíos
El tratamiento con crizotinib, un inhibidor de la tirosina cinasa (ITC) ALK, se ha convertido en una opción de primera línea habitual para los pacientes con CPNM avanzado y reordenamiento de ALK. Antes de la aparición del crizotinib, el tratamiento de referencia del CPNM no epidermoide consistía en un doblete de platino-pemetrexed seguido de pemetrexed de mantenimiento. Sin embargo, tras una respuesta inicial al crizotinib surge, invariablemente, una resistencia adquirida por múltiples mecanismos, que pueden incluir mutaciones secundarias en el dominio tirosina cinasa de ALK.
Actualmente hay varios inhibidores de ALK de última generación comercializados o en fase de desarrollo. Entre ellos figuran ceritinib, alectinib, brigatinib, ensartinib, entrectinib y lorlatinib. Todos estos fármacos presentan mayores potencias y actividades de inhibición de ALK frente a las mutaciones que confieren resistencia al crizotinib. Además, muchos de ellos muestran una mayor penetración en el SNC que el crizotinib.
Ceritinib de primera línea: ASCEND-4
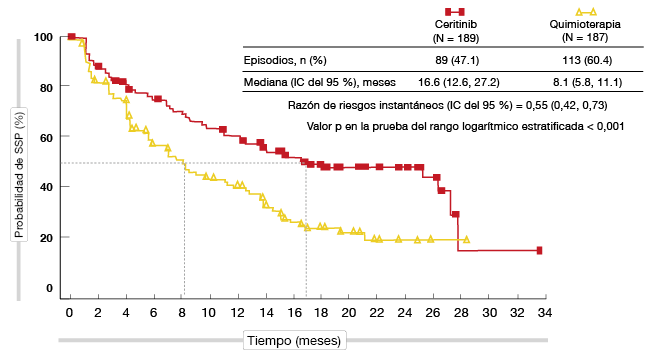
El ceritinib mostró una actividad antitumoral sólida en pacientes con CPNM avanzado con ALK positivo no tratados anteriormente y resistentes al crizotinib en los ensayos de fase I y II con un solo grupo ASCEND (ASCEND-1-3) y en un estudio de fase III aleatorizado (ASCEND-5). En el estudio de fase III, internacional, abierto y aleatorizado ASCEND-4, que se presentó en el Simposio presidencial de la WCLC, se comparó el uso de ceritinib, 750 mg/día, de primera línea con quimioterapia con platino y pemetrexed, seguido de pemetrexed de mantenimiento, en pacientes no tratados [1]; el criterio de valoración principal fue la SSP según una evaluación radiológica independiente y enmascarada. En este estudio se incluyó a un total de 376 pacientes, con 189 y 187 aleatorizados a recibir ceritinib y quimioterapia, respectivamente. Aproximadamente un tercio de los pacientes de cada grupo tenía metástasis cerebrales. En el 40% de estos pacientes se había administrado radioterapia cerebral previa.
El estudio fue positivo en relación con su criterio de valoración principal: la SSP fue significativamente mayor con el ceritinib que con la quimioterapia (16,6 frente a 8,1 meses, respectivamente; RRI, 0,55; p < 0,001; Figura). La mayoría de los subgrupos predefinidos obtuvieron un mayor beneficio en SSP con el ceritinib que con la quimioterapia. Las diferencias en SG no fueron significativas, aunque mostraron una tendencia a favor del ceritinib. Al cabo de 24 meses, las tasas de SG fueron del 70,6% y 58,2%. La TRO con el ceritinib superó a la obtenida con la quimioterapia en más de un 45% (72,5% frente al 26,7%). Además, los pacientes respondieron con más rapidez con el ceritinib, ya que la mediana del tiempo transcurrido hasta la primera respuesta fue de 6,1 y 13,4 meses, respectivamente. La mediana de duración de la respuesta fue de 23,9 y 11,1 meses, respectivamente. Los pacientes con y sin metástasis cerebrales obtuvieron beneficios del ceritinib, con una mejoría de la SSP en ambos grupos (RRI, 0,70 y 0,48, respectivamente). El tratamiento con el inhibidor de ALK deparó una tasa de respuesta intracraneal superior a la observada con la quimioterapia (72,7% frente al 27,3%) y el beneficio intracraneal del ceritinib fue duradero, con una mediana de duración de la respuesta de 16,6 meses.
Según resultados comunicados por los pacientes, las puntuaciones de síntomas del cáncer de pulmón mejoraron significativamente con respecto a la quimioterapia y se prolongó el tiempo transcurrido hasta un deterioro definitivo de los síntomas específicos del cáncer de pulmón. El perfil de seguridad del ceritinib fue coherente con el observado en estudios precedentes, con diarrea, náuseas y elevaciones de las enzimas hepáticas como acontecimientos adversos más frecuentes. El tratamiento consistió en ajustes de la dosis o interrupciones o aplazamientos de la administración, así como en medicación concomitante.
Figura: Criterio de valoración principal del estudio ASCEND-4: ventaja en SSP del ceritinib con respecto a la quimioterapia
J-ALEX: superioridad del alectinib respecto al crizotinib
Además del ceritinib, el alectinib representa una opción de referencia en el contexto de la progresión durante el tratamiento con crizotinib. En el ensayo japonés J-ALEX participaron 207 pacientes que habían recibido al menos una línea previa de quimioterapia. Fueron aleatorizados a recibir alectinib, 300 mg dos veces al día (es decir, dosis habitual del alectinib en Japón), o crizotinib, 250 mg dos veces al día, como primera línea [2]. También pudieron participar pacientes con metástasis cerebrales tratadas o asintomáticas.
El estudio fue sumamente positivo. El alectinib se mostró superior al crizotinib en lo que respecta al criterio de valoración principal, la SSP evaluada de manera independiente (no alcanzada con alectinib frente a 10,2 meses con crizotinib; RRI, 0,34; p < 0,0001). Un análisis de regresión múltiple de Cox estratificado reveló efectos sistemáticos del tratamiento a favor del alectinib respecto al crizotinib, algo que también fue aplicable a los pacientes con metástasis cerebrales. Dado que el SNC es un foco frecuente de progresión de la enfermedad en los pacientes con CPNM con ALK positivo, la actividad de nuevos compuestos inhibidores de ALK tiene especial importancia a este respecto. Se observó un desequilibrio entre los dos grupos de tratamiento en relación con el número de pacientes con y sin afectación del SNC, ya que este no fue un factor de estratificación en el estudio J-ALEX. En el grupo de alectinib se incluyeron más pacientes con metástasis cerebrales no tratadas.
Según los análisis de SSP independientes de los pacientes con y sin afectación del SNC en el momento basal, ambos grupos obtuvieron beneficios sumamente significativos con el alectinib en comparación con el crizotinib. La reducción del riesgo fue del 63% en los pacientes sin lesiones cerebrales (mediana de SSP, 20,3 frente a 10,0 meses; RRI, 0,37; p = 0,0001) y del 91% en aquellos con metástasis en el SNC preexistentes (no alcanzada frente a 10,2 meses; RRI, 0,09; p = 0,0062). En el grupo con lesiones cerebrales, los pacientes tratados con alectinib también evolucionaron significativamente mejor en cuanto al tiempo transcurrido hasta la progresión de la afectación del SNC (RRI, 0,16; p = 0,0492). De manera análoga, en aquellos sin metástasis cerebrales en el momento basal, el tiempo transcurrido hasta la aparición de afectación del SNC fue significativamente mayor con el alectinib (RRI, 0,17; p = 0,0019). En general, el alectinib mostró una mayor actividad en caso de afectación del SNC preexistente, así como un mayor potencial de prevenir la aparición de lesiones nuevas en el SNC.
Análisis actualizado de los resultados de SNC obtenidos con el alectinib
Estos datos se ven respaldados por un análisis conjunto de dos ensayos de fase II. En los estudios fundamentales NP28761 y NP28673 se investigó el uso de alectinib, 600 mg dos veces al día, después de la progresión durante el tratamiento con crizotinib. El estudio NP28761 se llevó a cabo en Norteamérica y el NP28673, a escala mundial. Los resultados revelaron tasas elevadas de respuesta y respuestas duraderas [3, 4]. Según un análisis conjunto de estos dos ensayos realizado con los datos obtenidos hasta la fecha de corte del 27 de abril de 2015, la TRO en el SNC fue del 64,0% y la duración de la respuesta en el SNC, de 10,8 meses en los pacientes con afectación del SNC mensurable en el momento basal [5].
En la WCLC, Ou y cols. presentaron datos agrupados actualizados, con fechas de corte correspondientes a 2016, para evaluar más detenidamente la eficacia sobre el SNC del alectinib en estos dos ensayos [6]. Según este análisis, la TRO en el SNC fue del 64,0% en los pacientes con enfermedad mensurable en el SNC y del 44,1% en aquellos con enfermedad mensurable y no mensurable combinadas. Se produjeron respuestas completas en el 22,0% y 28,7% de los pacientes, respectivamente, con control de la enfermedad en el SNC en el 90,0% y 86,0%, respectivamente. Estas respuestas en el SNC también fueron duraderas, ya que persistieron durante 11,1 y 13,8 meses, respectivamente.
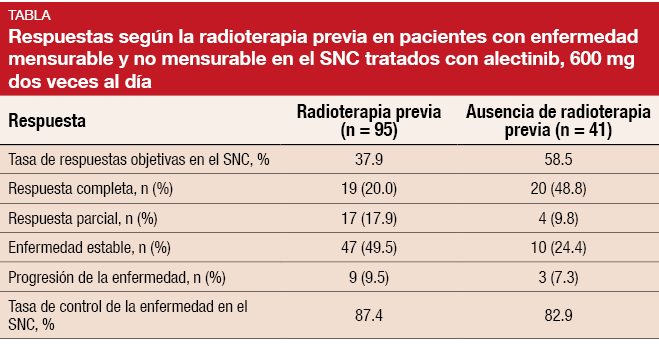
Además, los datos agrupados indican que el alectinib es activo en el SNC con independencia de la radioterapia previa. El 70% de los pacientes con enfermedad mensurable y no mensurable en el SNC había recibido radioterapia previa; en este caso, la TRO y TCE en el SNC fueron del 37,9% y 87,4%, respectivamente. En aquellos sin radioterapia previa, estas tasas fueron del 58,5% y 82,9%, respectivamente, y se produjeron respuestas completas en el 48,8% (Tabla).
Brigatinib y lorlatinib
Asimismo, se ha demostrado que los inhibidores de ALK de última generación en investigación brigatinib y lorlatinib tienen una actividad pronunciada, sobre todo en el SNC. Una actualización del ensayo de fase II aleatorizado fundamental ALTA, en el que se evaluó el uso de brigatinib en dos dosis (90 y 180 mg una vez al día) en pacientes resistentes al crizotinib, reveló una eficacia considerable y un perfil aceptable de seguridad en ambos grupos [7]. Con brigatinib 180 mg, la TRO fue del 54% según el comité de revisión independiente y la probabilidad de SG al cabo de un año, del 82%, La mediana de SSP obtenida con 180 mg superó considerablemente a la observada en el grupo de 90 mg (15,6 frente a 9,2 meses, respectivamente; RRI, 0,58). Los pacientes con metástasis cerebrales mensurables tratados con 180 mg de brigatinib presentaron una TRO intracraneal del 67%.
En un análisis independiente de un ensayo de fase I/II en curso y el estudio ALTA se evaluó la actividad del brigatinib en pacientes con metástasis en el SNC intracraneales; dicho fármaco deparó una tasa elevada de respuestas intracraneales, del 53% y 67% (con 180 mg de brigatinib), en los pacientes con metástasis mensurables de los dos estudios [8]. Además, los resultados correspondientes a la mediana de SSP intracraneal fueron sólidos, de 14,6 y 18,4 meses.
En lo que respecta al lorlatinib, en un estudio de fase I de búsqueda de dosis se demostró una actividad clínica significativa en pacientes con CPNM con ALK y ROS1 positivos, la mayoría de los cuales tenían metástasis cerebrales y habían recibido al menos un ITC de ALK previo [9]. En el grupo con ALK positivo, la TRO fue del 46% y la mediana de SSP, de 9,6 meses. El 42% de los pacientes con metástasis cerebrales y lesiones diana logró respuestas intracraneales. Se observaron respuestas duraderas en pacientes que habían recibido dos o más ITC de ALK previos. En general, el lorlatinib fue bien tolerado; la hipercolesterolemia fue la toxicidad relacionada con el tratamiento más frecuente y fue controlable con estatinas. La parte de fase II de este ensayo se está llevando a cabo en 57 centros de todo el mundo.
Selección del tratamiento: perspectiva actual
El arsenal creciente en el campo de los fármacos dirigidos contra ALK plantea varias cuestiones respecto a la selección de pacientes y la selección de ITC de ALK. “La observación de que muchos tumores resistentes al crizotinib mantienen la dependencia de ALK a lo largo del tiempo ofrece la justificación para administrar un tratamiento secuencial”, señaló Benjamin Solomon, MBBD, PhD, Peter MacCallum Cancer Centre, Melbourne, Australia [10]. Análisis retrospectivos han indicado la existencia de beneficios en supervivencia con tratamientos secuenciales con inhibidores de ALK en pacientes con CPNM con ALK positivo [11, 12].
A la luz de los últimos ensayos clínicos, aún no se ha establecido el tratamiento de primera línea óptimo para el CPNM avanzado con ALK positivo, aunque parece probable que se utilizarán inhibidores de última generación desde el principio, en lugar de crizotinib. “Los estudios de fase III en curso pronto nos facilitarán muchos más datos para abordar definitivamente esta cuestión”, apuntó el Dr. Solomon. Por ahora, tras el tratamiento de primera línea con crizotinib pueden utilizarse inhibidores de ALK de segunda generación, como ceritinib, alectinib y brigatinib. Cuando se produce progresión con estos fármacos, la elección del fármaco de tercera línea depende de factores tales como actividad en el SNC y mutaciones predominantes en el momento de la progresión. “Un tipo de inhibidor de ALK podría resultar más eficaz en el SNC que otros”, explicó el Dr. Solomon. Las actividades también varían en función de las mutaciones. Por ejemplo, la mutación I1171T confiere resistencia al alectinib, pero no al ceritinib. Los espectros de mutaciones frente a los inhibidores de ALK más modernos difieren del identificado en muestras resistentes al crizotinib [13]. Entre los inhibidores de ALK actualmente disponibles, el lorlatinib ofrece la cobertura más amplia de mutaciones, incluida la G1202R, que confiere resistencia al crizotinib, ceritinib y alectinib. Por consiguiente, los fármacos de tercera línea, como lorlatinib, pueden constituir una opción en casos de mutaciones de resistencia a ITC de ALK de segunda generación o de afectación del SNC.
Según indicó el Dr. Solomon, la evaluación de mutaciones en ALK mediante estrategias tales como la biopsia líquida podría llegar a orientar la elección del tratamiento con ITC de ALK. Es posible que se precisen estrategias combinadas para superar mecanismos inespecíficos de resistencia. “Esto incluye, potencialmente, combinaciones con inmunoterapia.”
BIBLIOGRAFÍA
- De Castro G et al., First-line ceritinib versus chemotherapy in patients with ALK-rearranged (ALK+) NSCLC: a randomized, phase 3 study (ASCEND-4). WCLC 2016, PL03.07
- Kim YH et al., Alectinib (ALC) versus crizotinib (CRZ) in ALK-positive non-small cell lung cancer (ALK+ NSCLC): primary results from phase III study (J-ALEX) – focus on CNS efficacy. WCLC 2016, MA07.03
- Shaw AT et al., Alectinib in ALK-positive, crizotinib-resistant, non-small-cell lung cancer: a single-group, multicentre, phase 2 trial. Lancet Oncol 2016; 17(2): 234-242
- Ou SH et al., Alectinib in crizotinib-refractory ALK-rearranged non-small-cell lung cancer: a phase II global study. J Clin Oncol 2016; 34(7): 661-668
- Gadgeel S et al., Pooled analysis of CNS response to alectinib in two studies of pretreated patients with ALK-positive non-small-cell lung cancer. J Clin Oncol 2016; 34(34): 4079-4085
- Ou SH et al., Updated pooled analysis of CNS endpoints in two phase II studies of alectinib in ALK+ NSCLC. WCLC 2016, MA07.01
- Camidge DR et al., Brigatinib in crizotinib-refractory ALK+ NSCLC: Central assessment and updates from ALTA, a pivotal randomized phase 2 trial. WCLC 2016, P3.02a-013
- Gettinger SN et al., Brigatinib activity in patients with ALK+ NSCLC and intracranial CNS metastases in two clinical trials. WCLC 2016, OA08.06
- Felip E et al., Safety and efficacy of lorlatinib (PF-06463922) in patients with advanced ALK+ or ROS1+ non-small-cell lung cancer (NSCLC). WCLC 2016, MA07.11
- Solomon B, Optimal application and sequence of ALK inhibition therapy. WCLC 2016, SC11
- Gainor JF et al., Progression-free and overall survival in ALK-positive NSCLC patients treated with sequential crizotinib and ceritinib. Clin Cancer Res 2015; 21(12): 2745-2752
- Watanabe S et al., Progression-free and overall survival of patients with ALK rearrangement-positive non-small cell lung cancer treated sequentially with crizotinib and alectinib. Clin Lung Cancer 2016; 17(6): 528-534
- Gainor JF et al., Molecular mechanisms of resistance to first- and second-generation ALK inhibitors in ALK-rearranged lung cancer. Cancer Discov 2016; 6(10): 1118-1133
More posts
Mejoras en la estadificación del cáncer de pulmón que pueden modificar la práctica clínica
Mejoras en la estadificación del cáncer de pulmón que pueden modificar la práctica
Antiangiogénesis con nintedanib: actividad en el mesotelioma y posibles biomarcadores
Antiangiogénesis con nintedanib: actividad en el mesotelioma y posibles biomarcador
¿Quién es candidato a la inmunoterapia?
¿Quién es candidato a la inmunoterapia? Johan Vansteenkiste, MD, PhD Unidad de O
Inmunoterapia: nuevos anticuerpos anti-PD-L1 y diversas pautas de combinación
Inmunoterapia: nuevos anticuerpos anti-PD-L1 y diversas pautas de combinación A
Biopsia líquida en el contexto de mutaciones en EGFR y de otro tipo
Biopsia líquida en el contexto de mutaciones en EGFR y de otro tipo En comparac
Tratamientos emergentes en el CPNM con ALK positivo: nuevas opciones, pero también nuevos desafíos
Tratamientos emergentes en el CPNM con ALK positivo: nuevas opciones, pero también